КАТАСТРОФИЧЕСКИЙ АНТИФОСФОЛИПИДНЫЙ СИНДРОМ. ВОПРОСЫ ПАТОГЕНЕЗА
Бицадзе В.О.1, Хизроева Д.Х.1, Идрисова Л.Э.1, Абрамян Р.Р.1, Андреева М.Д.2, Макацария А.Д.1 Дата публикации на сайте: 2015-09-21 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
Катастрофический антифосфолипидный синдром (КАФС) – наиболее тяжелая форма антифосфолипидного синдрома, проявляющаяся множественными микротромбозами микроциркуляторного русла жизненно важных органов и развитием полиорганной недостаточности на фоне высокого титра антифосфолипидных антител. В обзорной статье приведены международные подходы к терминологии, факторы риска, патогенеза, критерии диагностики, клинические симптомы и методы ведения больных с КАФС. Также представлен собственный опыт ведения 17 пациентов с КАФС. КАФС является состоянием, угрожающим жизни, поэтому требует неотложной терапии. Оптимального лечения КАФС не разработано. КАФС представляет общемедицинскую мультидисциплинарную проблему.
DOI: 10.17749/2070-4968.2015.9.2.032-053
Статья поступила: 25.05.2015 г.; в доработанном виде: 10.06.2015 г.; принята к печати: 22.06.2015 г.
Конфликт интересов
Авторы заявляют об отсутствии необходимости раскрытия финансовой поддержки или конфликта интересов в отношении данной публикации.
Все авторы сделали эквивалентный вклад в подготовку публикации.
Для цитирования
Бицадзе В.О., Хизроева Д.Х., Идрисова Л.Э., Абрамян Р.Р., Андреева М.Д., Макацария А.Д. Катастрофический антифосфолипидный синдром. Вопросы патогенеза. Акушерство, гинекология и репродукция. 2015; 2: 32-53.
Catastrophic antiphospholipid syndrome. Pathogenesis issues
Bitsadze V.O.1, Khizroeva D.Kh.1, Idrisova L.E.1, Abramyan R.R.1, Andreeva M.D.2, Makatsariya A.D.1
1 First Moscow State Medical Sechenov University of the Ministry of Health Russian Federation
2 Kuban State Medical University of the Russian Health Ministry, Krasnodar
Summary
Сatastrophic antiphospholipid syndrome (CAPS) is an uncommon, often fatal, variant of the antiphospholipid syndrome that results in a widespread coagulopathy and high titres os antiphospholipid antibodies and affects predominantly small vessels supplying organs with the development of multiorgan failure. International approaches on terminology, risk factors, pathogenesis, criteria of diagnostics, clinical symptoms and management of patients with CAPS are reviewed. Own clinical experience of management 17 patients with CAPS development also presented. CAPS is life-threatening condition but optimal treatment for CAPS is not developed yet. CAPS presents a multidisciplinary problem.
Key words
Antiphospholipid syndrome, rare disease, thrombotic storm, catastrophic APS.
Received: 25.05.2015; in the revised form: 10.06.2015; accepted: 22.06.2015.
Conflict of interests
The authors declared that they do not have anything to disclosure regarding funding or conflict of interests with respect to this manuscript.
All authors contributed equally to this article.
For citation
Bitsadze V.O., Khizroeva D.Kh., Idrisova L.E., Abramyan R.R., Andreeva M.D., Makatsariya A.D. Catastrophic antiphospholipid syndrome. Pathogenesis issues. Akusherstvo, ginekologiya i reproduktsiya / Obstetrics, gynecology and reproduction. 2015; 2: 32-53 (in Russian).
Corresponding author
Address: ul. Zemlyanoi Val, 62-1, Moscow, Russia, 109004.
E-mail address: gemostasis@mail.ru (Khizroeva J. Kh.).
Ключевые слова: Катастрофическая форма антифосфолипидного синдрома, антифосфолипидные антитела, осложнения беременности.
1 ГБОУ ВПО «Первый МГМУ имени И.М. Сеченова» Минздрава России, Москва
2 ГБОУ ВПО «Кубанский государственный медицинский университет» Минздрава России, Краснодар
Введение
Катастрофический антифосфолипидный синдром (КАФС, синдром Рональда Ашерсона) – наиболее тяжелая форма антифосфолипидного синдрома (АФС), которая проявляется множественными тромбозами жизненно важных органов и развитием полиорганной недостаточности на фоне высокого титра антифосфолипидных антител (АФА). Впервые синдром был открыт как явление в 1992 г. Р. Ашерсоном. Хотя КАФС развивается менее чем у 1% пациентов с АФС, это состояние является угрожающим жизни и поэтому требует неотложной терапии [6,33,38]. Оптимального лечения КАФС не разработано, и смертность достигает 50% [7,4].
По инициативе Европейского форума по вопросам АФС под руководством Р. Ашерсона в 2000 г. был создан международный регистр случаев КАФС, который включает описание клинической картины, лабораторных показателей, тактики лечения. Он постоянно пополняется новыми данными. Свободный доступ к регистру в Интернете по адресу: http://www.med.ub.es/MIMMUN/FORUM/CAPS.HTM. Периодический анализ данных регистра позволит расширить знания по проблеме КАФС. К настоящему времени зарегистрировано уже 280 случаев КАФС.
АФС и КАФС: определение
АФС – мультисистемное аутоиммунное состояние, характеризующееся сосудистыми тромбозами и/или прерыванием беременности и ассоциированное с повышенным уровнем АФА*. Катастрофическая форма АФС – наиболее тяжелая форма синдрома с вовлечением различных органов за относительно короткий период времени и, обычно, ассоциированный с микротромбозами. Наличие в анамнезе диагноза АФС и/или клинических проявлений циркуляции АФА весьма важны для диагностики КАФС, однако почти у половины КАФС-пациентов в анамнезе отсутствует АФА-циркуляция. В наиболее тяжелых случаях у меньшей части АФС-пациентов развиваются жизнеугрожающие множественные тромбозы различных органов, в основном микротромбозы, диагностируемые как КАФС.
Отличительными особенностями катастрофической формы являются:
- быстрое развитие микротромбозов с развитием дисфункции большинства органов и систем;
- ассоциация с другими тромботическими микроангиопатиями;
- проявления синдрома системного воспалительного ответа (ССВО);
- относительно высокая смертность, несмотря на оптимально подобранную терапию.
Факторы риска КАФС
Различные провоцирующие факторы выявляются более чем у 45% пациентов с КАФС [9]. В качестве такого фактора в большинстве случаев (40%) выступает инфекция (вирусная инфекция, инфекция верхних дыхательных путей, пищеварительного тракта, мочеполового тракта, пневмония, кожные язвы, сепсис, а также специфическая инфекция: малярия, сыпной тиф, лихорадка денге) [37]. Причинами развития КАФС могут быть следующие: массивный выброс провоспалительных цитокинов, повреждение эндотелия, развитие прокоагулянтного состояния под действием инфекционного агента. Провоцирующим фактором для развития КАФС могут стать хирургические вмешательства (например, гистерэктомия, кесарево сечение, холецистэктомия), в т.ч. даже небольшие (экстракция зуба, ретроградная холецистопанкреатография, кюретаж матки, биопсия), отмена антикоагулятнов, использование некоторых лекарственных препаратов (чаще всего оральных контрацептивов), онкологические заболевания (см. табл. 1).
Таблица 1. Факторы риска развития катастрофического антифосфолипидного синдрома (КАФС).
В большинстве случаев перед хирургическими вмешательствами возникает необходимость в отмене антикоагулянтов (например, варфарина). Таким образом, родилась гипотеза «двойного» и «тройного» удара, объясняющая причину развития КАФС. С одной стороны, хирургическое вмешательство обусловливает повреждение эндотелия, массивный выброс цитокинов, экспрессию прокоагулянтных факторов и формирование протромботического фенотипа, а с другой стороны, отмена антикоагулянтов также способствует активации коагуляции. Тем не менее, остается не известным, почему у одних пациентов КАФС развивается, а у других – нет. Возможно, для развития КАФС может существовать генетическая предрасположенность. Так, было показано, что при генотипе Вал (247) в гене b2-GPI чаще наблюдается формирование антител к b2-GPI и их большая активность по сравнению с пациентами с генотипом Лей (247) [39]. А у пациентов с СКВ найдена ассоциация между антигенами HLA-DPB1 и развитием АФС [33].
Основываясь на хорошо известных приобретенных и генетических факторах риска тромбозов, для облегчения диагностики АФС классификационные критерии синдрома, принятые в Саппоро, были пересмотрены. То есть, для определения «клинически значимого» профиля АФА (персистенция ВА и/или средние и высокие титры АФА методом ИФА) все АФА-позитивные пациенты должны рассматриваться с учетом принятых критериев, что принципиально важно для диагностики АФС и позволяет предотвратить гипердиагностику синдрома.
Для облегчения диагностики и обеспечения как можно более раннего начала терапии возникла необходимость стандартизировать диагностические критерии КАФС.
Критерии КАФС
Предварительные критерии классификации КАФС были сформулированы на 10-м Международном конгрессе по АФС в г. Таормина (Сицилия, Италия, сентябрь-октябрь 2002 г.) [8,20]. К ним относятся следующие:
1. Клинические проявления окклюзии сосудов трех или более органов и систем органов1.
2. Развитие клинических проявлений одновременно или, по крайней мере, с промежутком не более недели.
3. Гистологическое подтверждение окклюзии сосудов мелкого калибра, по меньшей мере, в одном органе2.
4. Серологическое подтверждение наличия АФА: волчаночный антикоагулянт, и/или антитела к антикардиолипину, и/или анти-b2-гликопротеину I3.
Диагнозу КАФС (definite CAPS) соответствует наличие всех четырех указанных критериев.
Вероятный диагноз КАФС (probable CAPS) можно заподозрить при обнаружении следующих комбинаций критериев:
– всех четырех критериев с вовлечением двух органов или систем органов;
– всех четырех критериев при невозможности лабораторного подтверждения АФА по истечении 6 нед. после получения первых положительных лабораторных результатов (в случае ранней смерти пациента с неустановленным ранее диагнозом АФС);
– критериев 1, 2, 4 (если окклюзию мелких сосудов невозможно подтвердить гистологически);
– критериев 1, 3, 4 (если третий эпизод развивается позже одной недели, но в течение первого месяца после вторичного поражения, несмотря на антикоагулянтную терапию).
Как видно из предварительных классификационных критериев, диагнозу КАФС соответствует наличие тромбозов в трех или более органах, развившихся в течение одной (и менее) недели, микротромбоз, как минимум, в одном органе и персистенция АФА. Однако если у пациента наблюдается только три из данных четырех критериев, ставится диагноз вероятного КАФС. Такой подход заставляет клиницистов быть настороже, позволяет вовремя поставить диагноз и рано начать терапию.
С современных позиций в понятие КАФС включают [16,26]:
– развитие множественных тромбозов за короткий период времени (менее одной недели);
– развитие мультиораганной недостаточности;
– тромбозы в мелких сосудах;
– развитие ССВО;
– высокий риск атипичных тромбозов (костного мозга, органов репродуктивной системы);
– лабораторные признаки АФС.
Важно отметить, что в условиях прогрессирующего развития тромбозов результаты лабораторных исследований по выявлению АФА могут быть отрицательными. Поэтому часто КАФС не диагностируется, из чего можно заключить, что реальная его частота значительно выше, чем полагают сегодня. При подозрении на КАФС необходимо повторное определение антител через несколько недель после развития осложнений [10,38]. При отрицательных результатах тестов на ВА и антикардиолипины обязательным является определение анти-b2-GPI, а также рекомендуется определение антител к фосфолипидам класса IgA [38].
АФА-профиль
Все еще нерешенным остается вопрос, почему у одних пациентов выявляется циркуляция АФА без каких-либо клинических проявлений, в то время как у других развивается яркая клиническая картина с рецидивирующими тромбозами и акушерскими осложнениями, почему у одних больных развиваются венозные тромбозы, а у других – тромбозы и эмболии в артериальном русле. Существуют предположения, что клиническая картина при АФС определяется классами циркулирующих антител и их сочетаниями.
Согласно данным мировой литературы, существует несколько важных, с практической точки зрения, подсказок, позволяющих определить клинически значимый АФА-профиль у пациентов, облегчающий диагностику АФС:
- транзиторные (временные) АФА – частая находка во время инфекционного процесса. Повторное определение АФА через 12 нед. и подтверждение их циркуляции (персистенция АФА) является решающим в диагностике АФС;
- положительный тест на волчаночный антикоагулянт (ВА) является лучшим предиктором АФА-ассоциированных тромбозов по сравнению с другими тестами определения АФА;
- несмотря на вероятность ложно-отрицательных или ложно-положительных результатов, определение ВА следует выполнять даже у тех пациентов, которые получают антикоагулянтную терапиию;
- специфичность антител к кардиолипину и b2-гликопротеину I повышается с увеличением титра антител;
- риск тромбозов у АФА-позитивных пациентов растет с увеличением количества факторов риска тромбозов;
- приблизительно половина АФС-пациентов на момент сосудистого тромбоза имеют в анамнезе, как минимум, один не-АФА-ассоциированный фактор риска тромбозов;
- IgG изотип АФА чаще ассоциируется с клиническими проявлениями синдрома по сравнению с IgM изотипом;
- несмотря на то, что IgA изотипы антикардиолипиновых и анти-b2-гликопротеин I антител не входят в пересмотренные диагностические критерии АФС, описаны случаи циркуляции данных изотипов у пациентов с клиническими проявлениями синдрома и без других факторов риска тромбозов;
- наличие циркуляции одновременно трех антифосфолипидных антител (волчаночного антикоагулянта, антител к кардиолипину, b2-гликопротеину I) является клинически более значимым, нежели циркуляция двух или одного видов АФА.
Помимо этого, клиницисты должны помнить, что клинические проявления антифосфолипидных антител могут различаться:
- АФА-циркуляция без клинических проявлений;
- АФА-циркуляция с клиническими проявлениями синдрома, которые не входят в официальные классификационные критерии АФС (например, тромбоцитопения, гемолитическая анемия, АФА-нефропатия, заболевания клапанов сердца);
- АФC в виде артериальных/венозных тромбозов и акушерскими осложнениями;
- КАФС.
Клиническая картина
При КАФС за короткий промежуток времени (в течение недели) происходит развитие множественных тромбозов различных органов. В противоположность некатастрофическому АФС наблюдается окклюзия сосудов мелкого калибра (хотя могут вовлекаться и более крупные сосуды). Для КАФС наиболее характерны почечные, легочные, церебральные и гастроинтестинальные тромбозы. Часто встречаются атипичные тромбозы, не характерные для типичного АФС.
К таким атипичным тромбозам относятся: надпочечниковые, селезеночные, тестикулярные, яичниковые, кожные, тромбозы поджелудочной, предстательной железы, костного мозга; тромбозы могут лежать в основе развития бескаменного холецистита, язв ЖКТ. У небольшого числа больных с КАФС развиваются тромбозы крупных сосудов (вен нижних конечностей, коронарных и церебральных артерий), то есть проявления, характерные для классического АФС. Характерен рецидив тромбозов, несмотря на адекватную антикоагулянтную терапию. Поражение почек, надпочечников, селезенки, легких ассоциируется с плохим прогнозом.
В результате тромботической микроваскулопатии возникает острая полиорганная недостаточность. Клинически это может проявляться нарушениями ЦНС, включая ступор, дезориентацию, развитие параличей, надпочечниковой недостаточности, ОРДС и дыхательной недостаточности, инфарктом миокарда, ЖКТ, почек и др.
В большинстве случаев поражение легких проявляется как острый респираторный дистресс-синдром легких (ОРДС) и легочная эмболия, в то время как легочные кровотечения, микротромбозы, отек легких выявляются редко. ОРДС является одним наиболее частых проявлений мультиорганной недостаточности у пациентов с КАФС (по данным регистра КАФС, ОРДС наблюдается в 25% случаев). Для понимания патогенеза КАФС крайне важным является то, что ОРДС является следствием синдрома системного воспалительного ответа, который характеризуется массивным выбросом цитокинов и повреждением тканей. Летальность при КАФС, несмотря на интенсивную терапию, достигает более 50%. Иммунный механизм развития ОРДС у пациентов с КАФС доказывает обнаружение АФА в жидкости, полученной при бронхо-альвеолярном лаваже [37].
Практически у 80% пациентов поражаются почки с развитием почечной микроангиопатии и окклюзией мелких сосудов. Часто (60% случаев) выявляются и симптомы поражения головного мозга (инсульт, транзиторные ишемические атаки, судороги, кома), однако микротромбозы сосудов головного мозга могут развиваться и гораздо чаще, чем это диагностируется, и могут являться причиной развития энцефалопатии при КАФС.
Более чем у 50% пациентов с КАФС наблюдается поражение сердца. В большинстве случаев оно проявляется развитием аортальной и митральной недостаточности, которые могли сформироваться ранее на фоне СКВ или АФС. У 25% пациентов развивается инфаркт миокарда. Кардиогенный шок у пациентов с КАФС может развиться в результате острой тромботической окклюзии коронарных сосудов, микротромбозов, внезапного прогрессирующего нарушения функции клапанов или массивной легочной эмболии. Причиной шока у пациентов с КАФС может быть также септический шок или острая надпочечниковая недостаточность. При подозрении на КАФС рекомендуется определение уровня тропонинов для исключения поражения сердечной мышцы. Помощь в установлении причины сердечной недостаточности может оказать чреспищеводная эхокардиография (ЧПЭхоКГ).
Некроз костного мозга является редким осложнением, которое описано у пациентов с метастатическими опухолями, ДВС-синдромом, развившимся после радио- или химиотерапии, у пациентов с септическим шоком. Теперь этот список пополнился еще и сообщениями о развитии некроза костного мозга при КАФС.
Собственный клинический опыт
В период с 2001 по 2015 г. мы обследовали 17 женщин с КАФС. Провоцирующими факторами развития КАФС в данных ситуациях были тяжелая преэклампсия, инфекция (пневмония, сепсис), оперативное вмешательство, уменьшение дозы антикоагулянтов, роды. Несмотря на терапию, КАФС закончился фатально у одной из пациенток, полиорганная недостаточность у которой развилась на фоне тяжелой формы преэклампсии, осложненной преждевременной отслойкой плаценты. Акушерские осложнения в анамнезе были выявлены у всех 17 пациенток (100%): синдром потери плода – у 13 (76,5%) пациенток, ПОНРП – у 2 (11,8%), тяжелая преэклампсия – у 11 (64,7%), преждевременные роды – у 7 (41,2%) пациенток. У 7 (41,2%) женщин в анамнезе были тромбоэмболические осложнения: тромбоз глубоких вен (ТГВ) нижних конечностей после родов у одной пациентки и рецидивирующий ТГВ с интервалом в два года на фоне приема оральных контрацептивов у другой, у трех женщин – илеофеморальный тромбоз во время предыдущих беременностей, у одной женщины после предыдущих преждевременных родов развился острый тромбофлебит подкожной вены бедра.
КАФС был лабораторно подтвержден у всех пациенток. ВА выявлен у всех пациенток, антифосфолипидные антитела к подгруппе фосфолипидов (фосфатидилсерин (ФС), фосфатидиловая кислота (ФК), фосфатидилинозитол (ФИ), кардиолипин или дифосфатидилглицерол (КЛ)) обнаружены в 9 случаях (52,9%), анти-b2-GPI – у 14 пациенток (82,4%), антитела к протромбину – в 3 (17,6%) случаях.
У всех пациенток был проведено обследование на предмет наличия генетической тромбофилии. Генетические формы тромбофилии были выявлены у всех 17 пациенток (100%). Обнаружены: мутация в гене метилентетрагидрафолатредуктазы MTHFR C677T гетерозиготная (41,2%) и гомозиготная формы (11,8%), гетерозиготная мутация в гене протромбина G20210A (5,9%), полиморфизм гена ингибитора активатора плазминогена PAI-I 675 4G/5G PAI-1 (41,2%), гетерозиготная форма полиморфизма – 455G/A гена бета-фибриногена (47,1%), гомозиготная форма полиморфизма I/D в гене тканевого активатора плазминогена t-PA (23,5%), а также гетерозиготные формы полиморфизмов генов ангиотензин-превращающего фермента (АПФ) I/D (29,4%), тромбоцитарного рецептора GPIa 807C/T (76,5%), ангиотензиногена 704 C/T (23,5%). Отмечалось существенное снижение функции протеина С и менее выраженное снижение уровня антитромбина III. Мультигенные формы тромбофилии выявлены в 52,9% случаев.
Патогенез КАФС
АФА влияют на все механизмы регуляции свертывания крови, полностью смещая баланс в пользу прокоагулянтного потенциала. Их влияние распространяется на все звенья системы гемостаза, включая функцию естественных антикоагулянтов, регуляцию фибринолиза, первичный и вторичный гемостаз, защитные свойства эндотелия, что получило название «тройной удар».
Возникает вопрос: с чем связано мгновенное прогрессирующее развитие КАФС? Ведь долгие годы у пациентов возможна лишь бессимптомная циркуляция антифосфолипидных антител при отсутствии клинических проявлений. Эти вопросы породили так называемую теорию «двойного удара», гипотезу о существовании дополнительного биологического фактора, необходимого для развития распространенной микроваскулопатии, активации эндотелия и массивного выброса цитокинов, характерных для КАФС.
Большое значение имело открытие связи между антифосфолипидным синдромом с инфекционным процессом. Одним из механизмов развития КАФС может быть молекулярная мимикрия [9]. Показано, что целый ряд микроорганизмов содержит в генетическом материале последовательности, гомологичные последовательностям в сайте связывания b2-GPI с фосфолипидами [1]. Таким образом, в ответ на внедрение в организм инфекционного агента возможно образование антител, перекрестно реагирующих с b2-GPI, то есть возникает реактивность по отношению к собственным структурам организма. Этот вопрос требует дальнейшего изучения в связи с широким распространением вирусных и бактериальных инфекций в популяции, в т.ч. и в акушерской практике. Нами было доказано, что инфекционные факторы являются причиной формирования приобретенной тромбофилии, развития эндотелиальной дисфункции, стимуляторами продукции АФА и активации коагуляции, развития хронического синдрома диссеминированного внутрисосудистого свертывания (ДВС-синдрома) и системного воспаления. Эти факторы в условиях инфекций у беременных могут играть ключевую роль в развитии целого спектра акушерских осложнений, включая преэклампсию, фетоплацентарную недостаточность, задержку внутриутробного роста плода, преждевременные роды [16].
На сегодняшний день все больше данных свидетельствуют о ключевой роли синдрома системного воспалительного ответа (ССВО) и эндотелиальной дисфункции в патогенезе КАФС. ССВО возникает не только при сепсисе; неинфекционные причины, в частности иммуноопосредованное поражение органов, является мощнейшим стимулом к формированию системного воспаления. Одно из проявлений ССВО – острый респираторный дистресс-синдром, который является одним из наиболее частых симптомов КАФС (обнаруживается у 25% пациентов с КАФС). Гипотезу о том, что КАФС является проявлением системного воспалительного ответа, подтверждает наличие общих медиаторных каскадов, характерных как для сепсиса, так и для КАФС, которые активируются под влиянием массивного повреждения тканей. К таким эндогенным медиаторам относятся, прежде всего, провоспалительные цитокины – фактор некроза опухолей TNF-a, интерерлейкин (IL)-1, фактор активации тромбоцитов (PAF), вазодилатирующие простагландины, активация комплемента и суперэкспрессия молекул адгезии на лейкоцитах, тромбоцитах и эндотелиальных клетках.
Ключевую роль в патогенезе КАФС, также как и при ССВО, играет эндотелиальная дисфункция, проявляющаяся нарушением антитромботической и противовоспалительной активности эндотелия. Активирует эндотелиальные клетки и, вероятно, способствует образованию подготовительного сигнала для КАФС комплекс иммунных стимулов, включающий цитокины (TNF-a, IL-1b, интерферон (IFN)), компоненты комплемента (С3b, С3b и С5а, мембран-атакующий комплекс С5b-9) и аутоантитела. Хорошо известно, что цитокины служат важнейшими медиаторами активации эндотелиальных клеток, в т.ч. и при КАФС. TNF-a, IL-lb, IFN могут стимулировать эндотелиальные клетки как в комплексе, так и отдельно друг от друга. К активаторам эндотелиальных клеток относятся и компоненты комплемента (С3b и С5а), а также мембран-атакующий комплекс, представленный С5b-9. Так, последний усиливает экспрессию эндотелиальных молекул адгезии и в особенности экспрессию TF, что соответствует состоянию повреждения эндотелия и тромбофилии, характерных для КАФС. Компонент комплемента Clq является необходимым кофактором для активации эндотелия под действием иммунных комплексов.
И, наконец, аутоантитела – непосредственно АФА, антиэндотелиальные антитела и антиядерные антитела, активируя эндотелиальные клетки, участвуют
в формировании стимулирующего сигнала, усиливая экспрессию молекул адгезии и TF. Эти же медиаторы (цитокины, компоненты активированного комплемента и аутоантитела) могут повышать адгезию лейкоцитов и тромбоцитов к сосудистому эндотелию и способствовать микротромбозу с локальным высвобождением токсичных медиаторов, включая протеазы и свободные радикалы кислорода. Такое взаимодействие между активированными эндотелиальными клетками, нейтрофилами и тромбоцитами в присутствии АФА, повышение адгезивных и прокоагулянтных свойств эндотелия являются триггером к развитию диффузной микроваскулопатии, характерной для КАФС.
В большинстве случаев для взаимодействия АФА с эндотелием как крупных сосудов, так и сосудов микроциркуляторного русла необходимо присутствие анти-b2-GPI, который взаимодействует с эндотелием при помощи так назызываемой ФЛ-связывающей последовательности аминокислот и 5-м домене молекулы, несущей высокий положительный заряд. В качестве возможного кандидата для связывания анти-b2-GPI может служить гепаранмульфат, который является главным протеогликаном сосудистой стенки и обусловливает формирование отрицательного заряда на поверхности эндотелия. Экспериментальные данные свидетельствуют о том, что обработка монослоя HUVEC гепаритиназой-1, способной разрушать гепарансульфат, приводит к дозозависимому ингибированию связывания анти-b2-GPI, а максимальная доза фермента предотвращает связывание анти-b2-GР1 на 65%. Недавно идентифицирована еще одна структура эндотелиальных клеток, ответственная за связывание анти-b2-GPl. Последние способны связываться с помощью 5-го домена с аннексином V- рецептором эндотелиальных клеток для t-PA. Однако другие структуры на эндотелии, с которыми связываются анти-b2-GPI, до сих пор не идентифицированы.
Взаимодействие АФА с эндотелием приводит к активации эндотелиальных клеток, что проявляется в увеличении экспрессии молекул адгезии (Е-селектина, ICAM-1, VCAM-1), продукции пpoвocпaлитeльныxцитoкинoв (TNF-a, IL-lb, IL-6). Цитокины, в свою очередь, активируют адгезию лейкоцитов, что способствует дальнейшему прогрессированию процессов воспаления и коагуляции.
Таким образом, АФА обладают прокоагулянтной и провоспалительной активностью, реализуя свое влияние на гуморальном и клеточном уровне (см. табл. 3).
Таблица 3. Механизмы патогенетической активности антифосфолипидных антител (АФА).
Важную роль в образовании аутоантител и развитии эндотелиальной дисфункции играют процессы апоптоза. АФА обладают способностью связываться с апоптозными клетками, в т.ч. и эндотелиальными, как непосредственно, так и опосредовано через aнти-b2-GPI, что обусловлено экспрессией фосфатидилсерина на мембране клеток, подвергающихся апоптозу. В то же время АФА сами могут индуцировать апоптоз. Апоптозные клетки являются первичными антигенными и иммуногенными источниками. В норме их элиминация осуществляется макрофагами. Одним из механизмов «узнавания» апоптозных телец является взаимодействие специфических рецепторов макрофагов с анионными ФЛ, что приобретает особое значение при АФС. Нарушение этих процессов приводит к нарушению фагоцитоза апоптозных клеток макрофагами и к моноклональной активации Т- и В-лимфоцитов против эпитопов мембранных ФЛ. Возможной причиной нарушения узнавания апоптозных телец макрофагами является активация процессов перекисного окисления, которые могут привести к модифицированию структуры ФЛ и появлению у них новых антигенных свойств.
Аннексин V, обладающий высоким сродством к ФЛ, проявляет свойства естественного антикоагулянта, является своеобразным маркером апоптоза и в настоящее время широко используется как проба на апоптоз. В физиологических условиях ФЛ мембраны апоптозных клеток связаны с аннексином V, который предотвращает образование аутоантител, связывание факторов свертывания с фосфолипидной матрицей и возможный чрезмерный прокоагулянтный ответ. АФА конкурируют с аннексином V за ФЛ, нарушают «аннексиновый щит», способствуют обнажению ФЛ, провоцируя аутоиммунный и прокоагулянтный ответ. С другой стороны, в условиях активации апоптоза может создаться относительный дефицит аннексина V в связи с чрезмерной экстернализацией анионных ФЛ. Таким образом, активация апоптоза приводит к увеличению образования АФА, замыкая порочный круг.
Системные ревматические заболевания характеризуются нарушением регуляции баланса цитокинов, проявляющимся избыточной продукцией провоспалительных цитокинов и дефицитом супрессорных факторов. Основными источниками цитокинов служат СD4+Т-лимфоциты, которые в зависимости от спектра продуцируемых цитокинов разделяют на Т-хелперы типа 1 (Тh1), синтезирующие IL-2, IFN-y и обусловливающие формирование клеточного иммунного ответа, и типа 2 (Th2), продуцирующие IL-4, IL-5, IL-6, IL-9, IL-10 и обусловливающие развитие гуморального иммунного ответа. Активация Тh1-клеточного ответа обнаруживается в основном при аутоиммунных заболеваниях (аутоиммунный тиреоидит, сахарный диабет типа 1), а Тh2-клеточный ответ характерен для аллергических реакций. При СКВ и ревматоидном артрите выявляется нарушение как в звене Тh1, так и в звене Th2.
В патогенезе КАФС ключевая роль принадлежит массивному выбросу провоспалительных цитокинов, прежде всего TNF-a, IL-6, IL-1, которые обусловливают развитие проявлений системного ответа на воспаление: ОРДС, отека головного мозга и дисфункции миокарда. Повышенный уровень этих цитокинов выявляется в сыворотке крови и в жидкости, полученной при бронхиальном лаваже у пациентов с ОРДС. В патогенезе ОРДС существенную роль играют нейтрофилы, которые аккумулируются в области тканевого повреждения. Так, в бронхоальвеолярном содержимом при ОРДС выявляется повышенное содержание IL-8 – важнейшего лейкоцитарного хемоаттрактанта. В формировании ОРДС участвует также IL-18, который активирует миграцию нейтрофилов и увеличивает проницаемость легочной ткани.
КАФС-подобные заболевания. В клинической практике встречаются АФА-позитивные пациенты, которые не соответствуют полностью критериям КАФС, но, тем не менее, являются сложным испытанием для клиницистов ввиду трудности диагноза. Согласно данным мировой литературы [19], такие больные диагностируются как «КАФС-подобные» и требуют тщательного мониторинга во избежание развития КАФС и, порой, такого же агрессивного лечения, как и АФС-пациенты. Больные с повышенным титром АФА (средние и/или высокие титры) с тромбозами сосудов среднего и крупного калибра двух органов с или без сопутствующего кровотечения, изолированным микротромбозом с кровотечением (легочное или надпочечниковое кровоизлияние), тяжелой тромбоцитопенией с или без кровотечения и тяжелым HELLP-синдромом с тромбозом одного органа могут быть включены в данную группу [19]. Авторы также рекомендуют включать в эту группу пациентов с тромбозом глубоких вен, осложнившихся легочной тромбоэмболией (подобно тромбозу левого желудочка, приводящему к инсульту) в сочетании с развитием других АФА-ассоциированных проявлений.
Микроангиопатический АФС
В то время как микроангиопатия является заболеванием сосудов мелкого калибра, тромботическая микроангиопатия (ТМА) подразумевает микроангиоптию с ишемией вследствие повышенного фибринообразования и/или гиперагрегации тромбоцитов, приводящую к окклюзии артериол и капилляров. Если у больных ТМА развивается неимунная гемолитическая анемия с шистоцитозом, то используется термин «тромботическая микроангиопатическая гемолитическая анемия» (ТМГА). На основании данных Международного КАФС Веб-Регистра, у пациентов с тромбоцитопенией по сравнению с больными без тромбоцитопении чаще развивается гемолиз, шистоцитоз, ДВС-синдром, повышение ПДФ [10]. Поэтому может встречаться группа КАФС-больных с преимущественно гематологическими проявлениями, у которых накладываются другие проявления ТМА в виде злокачественной гипертензии, тромботичекой тромбоцитопенической пурпуры (ТТП), гемолитико-уремического синдрома (ГУС), HELLP-синдрома и гепарин-индуцировнной тромбоцитопении (ГИТ). Таким образом, для АФА-позитивных больных с преимущественно ТМА-проявлениями был предложен термин «микроангиопатический АФС». К сожалению, истинное преобладание АФА у ТМА-больных неизвестно. Без сравнительных исследований между КАФС и другими ТМА трудно определить, являются ли антифосфолипидные антитела в каждом конкретном случае патогенными или нет.
Тромботический шторм
Остается неясным, почему у одних пациентов развивается типичная клиническая картина АФС (тромбозы крупных сосудов), тогда как у других наблюдается развитие прогрессирующих микротромбозов, которое авторы назвали «тромботическим штормом», и полиорганной недостаточности, то есть КАФС (см. табл. 4). В отсутствие основного запускающего триггера у больных наблюдаются массивные тромбозы с повреждением различных сосудистых структур. Почти у половины пациентов с картиной тромботического шторма наблюдается циркуляция АФА, но, к сожалению, детальный анализ АФА-профиля часто отсутствует. В сравнении с КАФС макротромбозы являются характеристикой тромботического шторма, хотя окклюзия микрососудистого русла часто недооценивается, указывая на прогрессирование данного протромботического фенотипа. Тромботический шторм основан на клинической картине. Это исключительно клинический фенотип, а не результат лабораторного тестирования и подтверждения циркуляции АФА.
Таблица 4. Клиническая характеристика тромботического шторма.
Примечание. Характеристики тромботического шторма, которые обычно не учитываются: рак (за исключением малого рака кожи); инфаркт миокарда в условиях ИБС; употребление кокаина с симптомами зависимости; ожидаемые тромботические осложнения, связанные с наличием внутрисосудистых устройств (катетеры, импланты); наличие пароксизмальной ночной гемоглобинурии или миелопролиферативные заболевния; множественная травма/тяжелая травма (например, множественный перелом конечности); преморбидный клинический статус до развития тромботических осложнений).
Согласно концепции тромботического шторма Kitchens (1998), несколько относительно сравнимых заболеваний (включая КАФС) с массивным тромбообазованием могут иметь единый патофизиологический механизм, приводящий к избыточному ответу на первоначальный протромботический стимул.
В настоящее время изучается генетика тромботического шторма. Существует гипотеза генетически обусловленных протромботических факторов риска, которые являются триггером избыточного тромбоза (http://hihg.med.miami.edu/thromboticstorm/). Такое массивное тромбообразование влечет за собой прогрессирование тромбоза [12]. В основе этого явления лежит прогрессирующая активация образования тромбина, угнетение фибринолиза за счет PAI-1, потребление антикоагулянтных факторов: протеина C и S, антитромбина III, развитие массивного тканевого повреждения, выброса цитокинов, развитие ДВС-синд-
рома и системного ответа на воспаление.
ССВО является универсальным процессом, который присутствует при различных клинических синдромах, включая сепсис, ДВС-синдром, КАФС, тромботическую тромбоцитопеническую пурпуру, гемолитико-уремический синдром, гепарин-индуцированную тромбоцитопению, для которых характерны разные патогенетические механизмы и этиологические факторы.
Сепсис и КАФС
Сепсис и КАФС также имеют сходства. Сепсис – это системный ответ на инфекционный процесс (ССВО), проявляющийся двумя и более из следующих факторов: а) температура >38°С или <36°С; б) частота сердцебиения >90 уд./мин.; в) частота дыхательных движений >20 уд./мин. или ПаСО2 <32 мм рт. ст.; г) уровень лейкоцитов в крови >12,000 клеток/мм3, <4000 клеток/мм3 или >10% незрелых форм клеток. Рассматривая КАФС также с позиций синдрома системного ответа на воспаление, становится понятным колоссальное сходство клинических проявлений КАФС и сепсиса. Развивающийся синдром системного провоспалительного ответа приводит к формированию распространенной громботической васкулопатии, что, в свою очередь, объясняет широкий спектр клинических проявлений КАФС, обусловленных повреждением тканей и развитием мультиорганной недостаточности, включая нарушение функции почек, ОРДС, развитие церебральных нарушений («острый церебральный дистресс-синдром»), снижение сократительной активности миокарда и развитие катехоламин-рефрактерной гипотензии. ССВО, таким образом, не оставляет организму шансов, поражая все защитные механизмы, обусловливая блокаду микроциркуляторного русла и развитие мультиорганной недостаточности. Как при сепсисе, так и при КАФС следствием системного ответа на воспаление, которое сопровождается массивным выбросом цитокинов и повреждением тканей, является развитие ДВС-синдрома.
В тех случаях, когда сепсис сопровождается развитием ДВС-синдрома, потенциальные осложнения включают в себя кровотечения, тромбоцитопению
и микротромбозы, также характерные для КАФС-больных.
То есть и патофизиология, и клинические проявления КАФС напоминают сепсис с развитием в итоге полиорганной недостаточности.
ДВС-синдром
Клиническая картина КАФС во многом напоминает декомпенсированный ДВС-синдром. В обоих случаях имеет место системная активация процессов коагуляции, развитие тромбозов микроциркуляторного русла и полиорганной недостаточности [13]. Декомпенсированный ДВС-синдром выявляется примерно у 20% пациентов с КАФС [14], что, вероятно, является отражением процессов системного воспаления. Кроме того, АФА часто обнаруживаются у пациентов с ДВС-синдромом [20]. Согласно нашему опыту, признаки хронического ДВС-синдрома развиваются во всех случаях КАФС, что обусловлено общими патогенетическими механизмами этих состояний. В основе КАФС и ДВС-синдрома лежит универсальный патологический процесс – синдром системного воспалительного ответа. Как при КАФС, так и при синдроме ДВС выявляются сходные провоцирующие факторы (травма, онкологические заболевания, акушерские осложнения, инфекции), наблюдается развитие эндотелиальной дисфункции, выброс провоспалительных цитокинов и активация коагуляции. Нарушение функции антикоагулянтного пути протеина С и состояние гипофибринолиза характерно как для КАФС, так и для ДВС-синдрома [33,35,38]. То есть причиной развития ДВС-синдрома является массивное повреждение сосудов микроциркуляторного русла, характерное для ССВО. Однако в отличие от КАФС, для ДВС-синдрома характерным является развитие геморрагических осложнений, вызванных массивным потреблением прокоагулянтных факторов и тромбоцитов. Интересно, что худший прогноз при ДВС-синдроме ассоциируется с повышенным уровнем PAI-1 и нарушением функции системы протеина С [38]. АФА при ДВС-синдроме могут появляться вторично вследствие массивного повреждения тканей, и их роль в патологическом процессе остается неизвестной. Для своевременной диагностики КАФС необходимо исследовать уровень АФА у всех пациентов с ДВС-синдромом при отсутствии провоцирующего фактора.
Таким образом, у пациентов с клиническими и лабораторными признаками ДВС-синдрома для определения лечебной тактики и прогноза весьма важным является определение антифосфолипидных антител.
Сходства ГИТ (гепарин-индуцированная тромбоцитопения) и КАФС
ГИТ обычно развивается через 4-10 дней после начала терапии гепарином. Это тяжелая форма (тип II) иммуно-опосредованного нарушения вследствие формирования антител против комплекса гепарин/тромбоцитарный фактор 4 (ТФ4). Учитывая, что для ГИТ характерны и артериальные, и венозные тромбозы, АФА-позитивные пациенты с тромбоцитопенией и множественными тромбозами, получающие гепарин, могут представлять большие затруднения для врачей-клиницистов. Кроме того, анти-гепарин/ТФ4-антитела (ИФА-методом) могут выявляться у 10% АФА-пациентов, не принимавших гепарин вследствие образования аутоантител к ТФ4. Эти антитела отличаются от антител, наблюдаемых у ГИТ-больных (против комплекса гепарин/ТФ4, а не ТФ4). У таких больных определение агрегации тромбоцитов, а именно гепарин-индуцированной активации и агрегации, может быть полезным для правильного диагноза.
Роль генетических форм тромбофилии в патогенезе КАФС. Помимо уже известных провоцирующих факторов КАФС (инфекция, оперативное вмешательство, опухоли, отмена антикоагулянтов, акушерские осложнения), роль в его развитии могут играть до сих пор неидентифицированные факторы. У 45% провоцирующий фактор развития КАФС остается неизвестным. Возможно, КАФС развивается при наличии генетической предрасположенности, определяющей развитие чрезмерно сильного ответа на различные провоцирующие факторы. Так, была доказана связь аллеля Val 247 b2-GPI с увеличением продукции и реактивности АФА [23,25].
У обследованных нами пациенток с КАФС генетические формы тромбофилии были выявлены в 100% случаев. В этой связи представления о патогенетических механизмах КАФС и полиорганной недостаточности требуют пересмотра. Ретроспективно можно сделать вывод о возникновении КАФС у описанных пациенток на фоне генетической тромбофилии, то есть можно говорить о ее ключевой роли в декомпенсации системы гемостаза, что клинически проявилось развитием КАФС.
Наши выводы и уточнения были доложены на II конференции по антифосфолипидному синдрому в г. Тутцинг (Германия, 18-21 апреля 2005 г.) и позитивно оценены ведущими специалистами в этой области, включая Рональда Ашерсона, чье имя носит КАФС. Наши выводы также согласуются с последними данными о роли мутации FV Leiden в патогенезе АФС [28]. Вместе с тем требуются дальнейшие исследования для определения роли нарушения функций антикоагулянтной системы вследствие наличия генетических форм тромбофилии (мутации FV Lеiden, протеинов C/S, дефицита антитромбина III) как факторов, усугубляющих подавление антикоагулянтной системы в условиях АФС и способствующих развитию его катастрофической формы.
Наши исследования показали, что и другие формы тромбофилий могут играть роль в патогенезе КАФС [23]. Так, в случае с описанной нами пациенткой удалось выявить мультигенную тромбофилию, затрагивающую преимущественно фибринолитическое звено гемостаза. При этом повреждение фибринолитической системы у пациентки связано сразу с несколькими механизмами: дисфибриногенемией, Хагеман-зависимым гипофибринолизом (мутация гена FXII), уменьшением активности эндогенного фибринолиза вследствие наличия наследственного дефицита t-PA и активацией экспрессии PAI-1 вследствие наличия полиморфизма 675 4G/5G PAI-1. Ранее было показано, что нарушение процессов фибринолиза способствует развитию тромботических осложнений при АФС. Эндотелиальная дисфункция, обусловленная циркуляцией АФА, сопровождается нарушением продукции t-PA и увеличением экспрессии PAI-1. Антифосфолипидные антитела, реагирующие с плазмином, способны связываться с t-PA и препятствовать его фибринолитической активности [20]. Кроме того, доказана роль нарушения фактор XII-зависимой активации фибринолиза в патогенезе акушерских осложнений (гестоза, внутриутробной задержки роста плода). У пациенток с осложненной беременностью выявляется увеличение маркеров тромбофилии фрагментов протромбина F1+2, FVIIa при пониженном уровне фактора XIIa и активатора плазминогена урокиназного типа u-PA [16]. Выраженное нарушение функций фибринолитической системы в условиях сочетания АФС с генетическими формами тромбофилии может приводить к невозможности адекватного ответа на протромботические стимулы, проявляться повышенной склонностью к тромбозам и способствовать развитию наиболее тяжелой, катастрофической формы АФС.
Таким образом, КАФС может развиваться на фоне генетической тромбофилии, частота которой в популяции, по обобщенным данным мировой литературы, составляет 15-20%. Сочетание приобретенной тромбофилии, обусловленной АФС, с генетическими де-фектами гемостаза существенно утяжеляет течение патологического процесса, то есть антифосфолипидный синдром обладает синергичным эффектом с генетически обусловленными тромбофилиями
в отношении развития акушерской патологии, тромботических осложнений и связанной с ними полиорганной недостаточности при КАФС. При этом наиболее неблагоприятным представляется сочетание АФС и мультигенных форм тромбофилии. Мультигенные формы тромбофилии были вывялены у 9 из 17 обследованных нами пациенток с КАФС (52,9%).
В рамках теории «двойного удара» генетические формы тромбофилии могут служить предрасполагающим фактором к развитию КАФС. Под действием уже известных факторов, провоцирующих КАФС (инфекция, применение оральных контрацептивов, отмена антикоагулянтов, хирургические вмешательства) на столь неблагоприятном фоне, создаются условия для декомпенсации системы гемостаза и развития КАФС. У 45% пациентов провоцирующий фактор развития КАФС остается неизвестным. Мы полагаем, что в качестве подобного фактора могут выступать генетические формы тромбофилии. Таким образом, требуется пристальное внимание к генетическим формам тромбофилии как к фактору, существенно утяжеляющему течение АФС, и необходимо дальнейшие изучение роли генетических тромбофилий в патогенезе КАФС.
Акушерские аспекты КАФС
В последнее время все больше внимания уделяется изучению роли КАФС в патогенезе акушерских осложнений. Антифосфолипидный синдром является системным процессом, поражающим все органы и ткани организма. Во время беременности в качестве важнейшего органа выступает плацента. Нарушения функции плаценты вследствие эндотелиальной дисфункции, ишемии, микротромбозов плаценты являются причиной развития акушерских осложнений: преэклампсии, HELLP-синдрома, отслойки плаценты. Появление данных осложнений у пациенток с АФС всегда подозрительно в отношении КАФС. Наличие антифосфолипидных антител считается фактором риска развития преэклампсии.
В последние годы развитие неблагоприятных исходов беременности, включая преэклампсию, обусловленных циркуляцией АФА, связывают с вовлеченностью в патогенез системы комплемента. На сегодня накоплено множество данных, свидетельствующих о роли воспаления в формировании акушерской патологии (преждевременные роды, повторные выкидыши, ВЗРП) при АФС. Важное знамение для развития нормальной беременности имеет баланс Th1- и Тh2-цитокинов. Известно, что при физиологической переменности преобладает эффект Th2, тогда как повышение продукции провоспалительных Thl-цитокинов (TNF-a, 1L-Ib, IL-6) ассоциируется с развитием невынашивания беременности и гестозов. АФС является главной причиной перинатальной смертности, связанной с такими патологическими состояниями, как ВЗРП, преждевременные роды, гестоз. Недавно была определена ведущая роль TNF-a как одного из главных медиаторов воспалительного ответа в развитии акушерских осложнений при АФА. Так, введение мышам IgG женщин с АФА и с привычным невынашиванием беременности в анамнезе приводило к быстрому подъему уровня TNF-a, источником которого являются как лейкоциты, так и непосредственно трофобласт, и ассоциировалось с развитием патологии беременности. Значительно меньшее число неудачных беременностей у мышей с дефектным геном TNF-a (TNF-a -/-) свидетельствует о том, что провоспалительные цитокины являются ключевыми медиаторами АФА-опосредованного повреждения [24]. Такой же эффект наблюдался и при введении антагонистов рецепторов TNF-a I типа, которые показали свою эффективность на многочисленных экспериментальных моделях ревматоидного артрита и которые, возможно, могут оказаться эффективными для профилактики акушерских осложнений при АФА. Однако эта гипотеза требует подтверждения в дальнейших исследованиях. Интересно, что у мышей с дефектом гена С5а (С5а -/-), а также при применении моноклональных антител к С5а и антагонистов рецепторов С5а введение АФА не приводило к увеличению продукции TNF-a и развитию патологии беременности. Таким образом, предполагаемый патогенетический механизм развития акушерской патологии связан с выработкой специфических антител к децидуальной ткани, которая в процессе дифференцировки экспрессирует фосфатидилсерин – мишень для АФА. АФА-зависимая активация комплемента приводит к увеличению продукции цитокинов, которые способствуют дальнейшей активации комплемента, прогрессированию воспалительного ответа и усугублению тканевых повреждений [33].
При АФС выявляется снижение уровня IL-3 и GM-CSF, что ассоциируется с развитием акушерских осложнений. IL-3 и GM-CSF регулируют процессы инвазии трофобласта, формирования плаценты и роста плода. Кроме того, IL-3 активирует пролиферацию мегакариоцитов и увеличивает количество тромбоцитов. При нормальной беременности содержание этих факторов значительно увеличивается под действием прогестерона. У мышей с экспериментальным АФС введение рекомбинантного IL-3 предотвращает развитие патологий беременности. Важно, что ацетилсалициловая кислота предупреждает развитие выкидышей как в экспериментальных моделях АФС, так и у человека. Ингибируя ЦОГ-1, ацетилсалициловая кислота снижает продукцию ТХА2, что приводит к уменьшению агрегации тромбоцитов и способствует увеличению продукции лейкотриенов, которые, в свою очередь, стимулируют синтез IL-3. Однако подобный эффект ацетилсалициловой кислоты наблюдается лишь при его применении в низких дозах. Таким образом, применение низких доз ацетилсалициловой кислоты (75-81 мг/сут.) является важным компонентом комбинированной терапии АФС. Кроме того, показано, что ципрофлоксацин индуцирует экспрессию IL-3. Следовательно, антибиотикотерапия инфекционных заболеваний может играть важную роль в профилактике КАФС [11].
Возможно, активированный эндотелий препятствует процессам нормальной инвазии трофобласта и нарушает процессы замещения эндотелия клетками трофобласта в спиральных артериолах, что приводит к нарушению плацентации и развитию акушерских осложнений (невынашивание беременности, ВУЗРП). Сыворотка женщины с АФС и повторными самопроизвольными выкидышами в анамнезе ингибирует адгезию трофобласта к эндотелию in vitro.
Так как осложнения беременности до сих пор не рассматривались в качестве критериев КАФС, последний может быть гораздо более частым явлением, чем предполагалось ранее, и в большинстве случаев не диагностируется вовремя. Мы считаем, что такие типично акушерские осложнения как эклампсия, HELLP-синдром, преждевременная отслойка нормально расположенной плаценты могут быть проявлениями КАФС. Таким образом, КАФС является гораздо более распространенным явлением, чем было принято считать до сих пор. У всех пациенток с такими осложнениями беременности мы настоятельно рекомендуем обследование на предмет АФА.
АФА выявляются у 69% женщин с HELLP-синдромом. АФА у пациенток с HELLP-синдромом были выявлены и в других исследованиях, причем считается, что циркуляция АФА является фактором, способствующим более раннему развитию данного осложнения [27].
В связи с тем, что КАФС является системной патологией, наблюдается поражение не только материнского организма и плаценты, но и плода. Недавно была показана роль ССВО у плода и плодовой тромбофилии как факторов, способствующих развитию материнских и плодовых осложнений при беременности. Так, при хронической инфекции и синдроме системного воспалительного ответа у матери развивается ССВО у плода [24]. Согласно нашим исследованиям, в патогенезе осложненного течения беременности и репродуктивных потерь ключевая роль принадлежит
не только тромбофилии матери, но и плодовой тромбофилии [7,23]. Возможно, генетическая тромбофилия и циркуляция АФА у плода является одним
из важнейших факторов, обуславливающих развитие осложнений беременности и осложнений со стороны плода (внутриутробная задержка роста плода, синдром потери плода, преждевременные роды).
Обобщая современные знания о патогенезе КАФС, можно сведать вывод, что при наличии антифосфолипидного синдрома и генетических форм тромбофилии нередко под влиянием различных провоцирующих факторов (беременность, инфекция, отмена оральных антикоагулянтов, прием оральных контрацептивов) создаются условия для декомпенсации системы гемостаза. При этом происходит формирование системного воспалительного ответа и протромботического фенотипа с развитием системной эндотелиальной дисфункции и ДВС-синдрома. Эти процессы являются патогенетической основой для развития полиорганной недостаточности (схема 1).
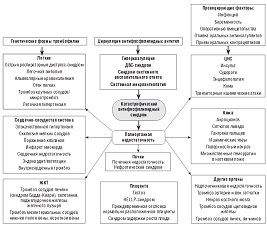 | Схема 1. Патогенез катастрофического антифосфолипидного синдрома (по R.A. Asherson, дополненная А.Д. Макацарией, В.О. Бицадзе). |
Трудности диагностики КАФС
Ввиду многообразия патогенетических механизмов диагностика катастрофической формы АФС представляет собой определенные трудности, а дифференциальная диагностика в острый период не может быть сведена к одному единственному заболеванию. Как указывалось выше, существует целый спектр тромботических микроангиопатических состояний (ТТП, ГУС, HELLP, КАФС), при которых в момент их развития очень трудно вовремя правильно поставить диагноз ввиду схожести клинических проявлений. Необходима постоянная оценка и тщательный мониторинг состояния больного. Не всегда наличие АФА при тромбозах является проявлением только АФС. Кроме того, нельзя исключать вероятность ложноположительных и ложноотрицательных результатов АФА-диагностики. Ложноположительные АФА (обычно низкие титры) чаще всего ассоциируются с инфекционным процессом [2,11,34] и/или приемом антикоагулянтов (положительный ВА) [5,18]. В то время как ложноотрицательные АФА у АФС или КАФС больных – явление нередкое именно в момент тромбоза, возможно, вследствие избыточного потребления антифосфолипидных антител.
Именно в связи с этим для облегчения дифференциальной диагностики пациентов с множественными тромбозами был создан пошаговый алгоритм, позволяющий правильно поставить диагноз.
Почти у половины больных КАФС развивается без циркуляции АФА в анамнезе. Поэтому АФС-диагноз, основанный на пересмотренных в Саппоро критериях, или персистенция клинически значимых антифосфолипидных антител (ВА-циркуляция и/или средние и высокие титры АФА, ИФА-методом) без клинических проявлений АФА является очень важной для диагностики.
Тромбозы трех и более органов с развитием менее чем за неделю являются «краеугольным камнем» КАФС. Тем не менее, тромбозы только двух органов с развитием менее недели (с или без развития третьего эпизода тромбоза более чем за неделю, но менее чем в течение месяца, несмотря на антикоагулянтную терапию) могут привести к диагнозу «вероятного КАФС». Гематологические проявления не должны учитываться как вовлечение отдельного органа.
Что касается микротромбозов, то их гистологическое подтверждение является одним из условий КАФС. Однако проведение биопсии не представляется возможным в острый период КАФС вследствие тяжелой тромбоцитопении и/или нестабильного клинического состояния пациента. Диагноз должен быть пересмотрен после получения результатов биопсии или аутопсии. Тем не менее, следует тщательно взвесить все риски и преимущества выполнения любых процедур, включая биопсию.
Самым трудным аспектом диагностики КАФС является клиническая ситуация, когда у больного с множественными тромбозами различных органов циркуляция АФА выявляется только в первый раз и, помимо циркуляции АФА, имеют место нетромботические факторы риска (например, послеоперационный период, инфекция с развитием сепсиса или без него, проявления другой тромботической микроангиопатии, ДВС-синдром, ГИТ) [2,14]. Трудности возникают при выявлении ВА на фоне антикоагулянтной терапии и/или низкого титра АФА. Диагностика катастрофической формы АФС в такой ситуации требует внимательного и тщательного анализа состояния пациента, так как возможны другие причины развития множественных тромбозов различных органов.
Правильная постановка диагноза и ведение пациентов с множественными тромбозами и нехарактерными проявлениями АФС – работа целой команды специалистов различного профиля, включая ревматологов, гематологов, инфекционистов, нефрологов, реаниматологов, акушеров [21]. Картина КАФС может развертываться постепенно, перекрывая проявления других микроангиопатий. Подозрение на КАФС всегда должно иметь место в случае тромбозов. Очень важно начинать терапию как можно ранее, не дожидаясь подтверждения АФА-тестов.
Принципы терапии КАФС
Ранняя диагностика и начало адекватной терапии являются критическими для исхода КАФС. При подозрении на КАФС незамедлительно должна быть начата агрессивная терапия. Следует отметить, что серологическое выявление маркеров АФС или обнаружение ВА требует времени или часто невозможно, а порой на фоне прогрессирующих тромбозов или вследствие длительной иммуносупрессивной терапии результаты лабораторных исследований могут быть отрицательными. Таким образом, установление диагноза КАФС в соответствии с имеющимися на сегодня международными критериями зачастую является очень сложной задачей.
Учитывая, что КАФС является тромбофилическим расстройством с характерной распространенной микроваскулопатией, патогенетически обоснованной представляется терапия с использованием антикоагулянтов. Кроме того, терапия должна быть направлена на предотвращение образования и циркуляции медиаторов системного воспалительного ответа и тканевых повреждений (АФА, цитокинов, продуктов активации комплемента, антиэндотелиальных антител) [31,32]. Анализ комбинированной терапии показал, что лучшие результаты (выживаемость 68%) были получены при комбинации антикоагулянтов, кортикостероидов, заместительной терапии свежезамороженной плазмой и внутривенного иммуноглобулина. В связи
с этим на 10-м Международном конгрессе по АФС в г. Таормина был выработан следующий алгоритм ведения больных с КАФС.
Терапию КАФС следует начинать с применения препаратов первого ряда – антикоагулянтов и кортикостероидов. Если клинический эффект отсутствует или прогрессируют тромбозы, несмотря на антикоагулянтную терапию, то применяют препараты второго ряда. При отсутствии клинического эффекта и прогрессирующем ухудшении состояния пациента встает вопрос о применении препаратов третьего ряда, опыт использования которых ограничен и/или эффективность которых неизвестна (см. табл. 5).
Таблица 5. Возможности терапии катастрофического антифосфолипидного синдрома (КАФС).
Схема применения различных препаратов при КАФС представлена в таблице 6.
Таблица 6. Схема терапии катастрофического антифосфолипидного синдрома (КАФС).
Важнейшее значение имеет устранение возможных триггерных факторов КАФС. При подозрении на инфекцию необходимо как можно более раннее начало антибиотикотерапии [11,31,34].
Знания о патогенезе КАФС позволяют утверждать, что эффективная терапия и профилактика КАФС возможны лишь при одновременном влиянии на процессы воспаления и коагуляции. Учитывая, что КАФС является тромбофилическим расстройством с характерной распространенной микроваскулопатией, патогенетически обоснованной представляется терапия с использованием антикоагулянтов. Кроме того, терапия должна быть направлена на предотвращение образования и циркуляции медиаторов системного воспалительного ответа и тканевых повреждений (АФА, цитокинов, продуктов активации комплемента, АЭАТ), то есть необходимы такие лекарственные средства, которые способны одновременно блокировать оба патогенетических механизма заболевания – прокоагулянтный и провоспалительный [4,13].
Препаратом выбора сегодня является низкомолекулярный гепарин (НМГ), обладающий антикоагулянтными свойствами и противовоспалительной активностью. В нашей практике мы использовали различные препараты низкомолекулярных гепаринов (эноксапарин натрия, надропарин кальция, дальтепарин натрия, бемипарин натрия).
Гепарин в 1000 раз увеличивает активность антитромбина III, что приводит к эффективному ингибированию тромбина, фактора Xа и IXа. В достаточно высоких концентрациях гепарин способен оказывать дополнительное ингибирующее влияние на тромбин через гепарин-кофактор II. Некоторые ограничения антикоагулянтного эффекта гепарина связаны с невозможностью в комплексе с АТ III ингибировать тромбин и фактор Xа при фиксации последних на поверхности фибрина и фосфолипидов. Эффективность применения гепарина у пациентов с КАФС обусловлена не только его воздействием на систему гемостаза, но и, возможно, способностью адсорбировать АФА, предотвращать их связывание с клетками-мишенями и ингибировать активность комплемента [15,32].
Более предпочтительным представляется использование низкомолекулярных гепаринов, так как препараты этой группы: а) обеспечивают хороший антикоагулянтный эффект; б) в меньшей степени нуждаются в кофакторе антитромбине III (АТ III), когда в условиях КАФС угнетаются естественные антикоагулянтные пути; в) представляют меньшую опасность развития гепарин-индуцированной тромбоцитопении, так как НМГ практически не взаимодействует с тромбоцитами и фактором 4-тромбоцитов. Кроме того, НМГ обладают еще целым рядом преимуществ перед нефракционированными гепаринами:
– хорошая биодоступность и быстрое всасывание при подкожном введении;
– более предсказуемое антикоагулянтное действие;
– отсутствие необходимости в регулярном лабораторном контроле в период лечения;
– длительность действия и возможность подкожного введения 1-2 раза в сутки.
Противотромботическую активность НМГ длительно связывали исключительно с преобладанием анти-Xa-активностью над антитромбиновой активностью. Позднее выяснилось, что только 30% противотромботической активности НМГ осуществляется через антитромбин III и на 70% через эффекты, связанные с эндотелием, в частности, с высвобождением естественного ингибитора внешнего пути свертывания TFPI. Активация тканевого фактора является ключевым этапом развития коагуляции и воспаления, а также важной частью патогенеза гнойно-септических заболеваний, КАФС, ДВС-синдрома, что объясняет эффективность применения НМГ при этих состояниях.
Спектр заболеваний и патологических состояний, при которых НМГ эффективны, чрезвычайно широк. На сегодняшний день НМГ является препаратом выбора у беременных с тромбофилией и позволяет предупредить развитие как венозных тромбозов и тромбоэмболий, так и целого ряда акушерских осложнений: невынашивания беременности, преэклампсии, преждевременной отслойки нормально расположенной плаценты, внутриутробной задержки роста плода, антенатальной гибели плода, фетоплацентарной недостаточности [29]. Недавно были опубликованы результаты исследования LIVE-ENOX [22,36]. Применение эноксапарина у 180 беременных женщин с тромбофилией и синдромом потери плода в анамнезе было эффективным (рождение живых детей) в 84% случаев. Не было отмечено ни одного случая тромбоза, ни одного клинически значимого кровотечения или эпизода тромбоцитопении. Согласно нашим данным, лучшие исходы имеют место у пациенток, которые получали терапию с ранних сроков беременности и в фертильном цикле в рамках подготовки к беременности. Одним из определяющих факторов применения гепаринов в акушерстве является отсутствие тератогенного и эмбриотоксического эффектов, поскольку они не проникают через плаценту.
В настоящее время разрешены и наиболее часто применимы в акушерской практике НМГ первого поколения – надропарин кальция, дальтепарин, эноксипарин и НМГ второго поколения – бемипарин натрия.
В соответствии с конкретной клинико-гемостазиологической ситуацией используются профилактические или лечебные дозы нефракционированного гепарина (НФГ) и НМГ (см. табл. 7).
Таблица 7. Рекомендуемые в акушерстве режимы использования НФГ и НМГ.
*В зависимости от степени риска тромбообразования.
В настоящее время разработаны и все более широко применяются НМГ второго поколения. Они характеризуются узким распределением полисахаридных цепей с высоким соотношением анти-Ха:анти-IIa активности и, соответственно, более выраженным антитромботическим эффектом. Классическим представителем этой группы препаратов является бемипарин натрия. Он характеризуется стабильной молекулярной массой 3600 дальтон и узким распределением полисахаридных цепей, а также соотношением анти-Ха:анти-IIa активности – 8:1 и большим периодом полувыведения — около 5 ч, что превышает эти показатели других НМГ (дальтепарина, эноксапарина и надропарина).
В 2012 г. были опубликованы результаты исследования по применению бемипарина в профилактике привычного невынашивания (ПН) беременности, ассоциированного с антифосфолипидным синдромом (АФС), при лечении НМГ или низкодозированной ацетилсалициловой кислотой (НДА) в монотерапии. Было обнаружено, что применение во время беременности НМГ второго поколения (бемипарина) вместо НДА с целью профилактики ПН у женщин с АФС является безопасным и эффективным методом, обеспечивающим высокую частоту живорождений при отсутствии каких-либо материнских и фетальных осложнений: частота живорождений в группе бемипарина составила 86,3% по сравнению с 72,1% в группе НДА.
Аналогичное исследование по применению бемипарина у беременных с тромбофилией провели испанские ученые [39]. В период с 2003 по 2006 г. они обследовали 38 женщин с повышенным риском тромбоэмболических заболеваний. В соответствии с симптомами они получали низкомолекулярный гепарин (бемипарин и тинзапарин), длительность терапии составила в среднем 7,5 мес. За все время исследования осложнения наблюдались всего в трех случаях (один – экхимоз в месте инъекции и два незначительных маточных кровотечения, обусловленные патологией плаценты). Роды проходили безопасно и без осложнений, связанных с применением низкомолекулярного гепарина. Авторы делают заключение: терапия тромбофилических состояний у беременных женщин с использованием низкомолекулярного гепарина бемипарина безопасна и эффективна.
У 646 женщин групп риска по развитию тромботических осложнений после операции кесарева сечения при использовании бемипарина в дозе 3500 МЕ в сутки был зафиксирован только один эпизод венозной тромбоэмболии [17].
В отечественной практике проводилось исследование гепаринопрофилактики в цикле ЭКО. Применение бемипарина при плановой гиперстимуляции яичников привело не только к эффективному снижению эндогенного тромбинового потенциала, но и к значительному (в 6,4 раза) увеличению числа случаев наступления беременности [3].
В последнее время пристальное внимание уделяется изучению влияния НМГ на процессы воспаления и возможность его применения для лечения различных заболеваний, включая воспалительные заболевания кишечника, бронхиальную астму, аутоиммунные и сердечно-сосудистые заболевания. Так, показана способность НМГ ингибировать адгезию лейкоцитов и экспрессию TNF-a.
Эффективность глюкокортикоидов при КАФС обусловлена их способностью ингибировать развитие системного ответа на воспаление вследствие блокирования экспрессии NF-kB-фактора транскрипции большинства медиаторов воспаления. Следует отметить, что сами по себе глюкокортикоиды не влияют на риск развития повторных тромбозов.
Применение внутривенного иммуноглобулина может быть эффективным в связи с его способностью блокировать связывание антител с рецепторами макрофагов, увеличивать Т-клеточный супрессорный ответ и, возможно, уменьшать синтез и активировать разрушение циркулирующих IgG за счет связывания с ними путем антиидиотипического взаимодействия, регулировать продукцию цитокинов и активацию системы комплемента. Иммуноглобулин применяется также для лечения тромботической тромбоцитопенической пурпуры и особенно эффективен у пациентов с тромбоцитопенией. Применение иммуноглобулина противопоказано при дефиците IgA, поскольку в этом случае оно может спровоцировать анафилактическую реакцию. С осторожностью и по возможности в минимальных дозах следует применять иммуноглобулин у пациентов при поражении почек, так как препарат может спровоцировать развитие почечной недостаточности. Особенно это касается лиц старше 65 лет, принимающих препараты с возможным нефротоксическим действием и при сепсисе. Кроме того, при применении иммуноглобулина может наблюдаться сильная головная боль, обусловленная развитием асептического менингита, и повышение вязкости крови, хотя развития тромбозов после инфузии иммуноглобулина не выявлено.
В последнее время все больше данных за успешное применение плазмафереза при КАФС, являющегося на сегодняшний день одним из основных методов терапии данного состояния. Эффективность плазмафереза связана с удалением при данной процедуре АФА, провоспалительных цитокинов TNF-a, IL-1, IL-6, компонентов комплемента и других медиаторов воспаления, что препятствует прогрессированию воспалительного ответа, процессов коагуляции и повреждения тканей. Повторные плазмаферезы оправданы при наиболее рефрактерных случаях КАФС, когда остальная общепринятая терапия не приносит положительного результата. Показано, что плазмаферез является наиболее эффективным методом терапии микроангиопатической гемолитической анемии, ассоциированной с АФС.
Заместительная терапия свежезамороженной плазмой необходима, в особенности, при явных признаках ДВС-синдрома и микроангиопатической гемолитической анемии (появление большого числа шистоцитов – фрагментов эритроцитов – в периферической крови). При этом одна из основных целей заместительной терапии – восполнение уровня естественных антикоагулянтов и в первую очередь АТ III и протеина С [14].
Весьма эффективно применение концентратов антитромбина III и протеина С. Так, рекомбинантный активированный протеин С (дротрекогин) обладает мощным антитромботическим (снижает уровень D-димера), противовоспалительным (снижает концентрацию IL-6) и профибринолитическим эффектами. Его эффективность доказана у пациентов с тяжелым сепсисом [4,9]. В связи с ключевой ролью системного воспалительного ответа в патогенезе КАФС применение этого препарата обосновано и у пациентов с КАФС. Дефицит протеина С при сепсисе (<80%) от нормы ассоциируется с развитием ОРДС и худшим прогнозом. В связи с ключевой ролью системного воспалительного ответа в патогенезе КАФС применение этого препарата обосновано и у пациентов с данным патологическим состоянием.
Сообщается об успешном применении фибринолитиков, простациклина, дефибротида, даназола, циклоспорина, азатиоприна и, наконец, спленэктомии в терапии КАФС.
Патогенетической основой применения простациклина является его способность к вазодилатации и ингибированию функции тромбоцитов, однако простациклин следует применять с осторожностью, учитывая наличие данных о возможном развитии «рикошетных» тромбозов. В литературе описан один успешней случай применения простациклина при КАФС (5 нг/кг/сут. в течение 7 дней) [27,31]. Применение простациклина ингаляционно возможно у пациентов с ОРДС при жизнеугрожающей гипоксемии, несмотря на рекомендуемую терапию, однако повышения выживаемости при этом показано не было [27].
Применение фибринолитиков не получило широкого распространения в связи с риском кровотечений. Возможными показаниями к фибринолитической терапии у пациентов с КАФС являются массивная тромбоэмболия легочной артерии с развитием шока и дисфункции правого желудочка, острый тромбоз средней мозговой артерии, артериальные тромбоэмболии, массивный тромбоз вен конечностей с угрозой развития гангрены, острый инфаркт миокарда.
Роль циклофосфамида заключается в предотвращении «ребаунд»-продукции патогенных аутоантител аутоагрессивными лимфоцитами после проведения сеансов плазмафереза и/или на фоне обострения СКВ, хотя его эффективность не была доказана в исследовании у 80 пациентов с КАФС [36].
Анкрод представляет собой очищенную фракцию яда змеи (Malayan pit). Его введение способствует нормализации фибринолиза, продукции простациклина и уровня активатора плазминогена. В связи с тем, что в условиях синдрома системного воспалительного ответа и ДВС-синдрома, которые являются неотъемлемой частью КАФС, происходит угнетение системы фибринолиза, применение анкрода является патогенетически обоснованным и может быть эффективным для терапии КАФС. В России Анкрод не зарегистрирован.
Дефибротид представляет собой щелочную соль односпиральной молекулы ДНК, является агонистом аденозиновых рецепторов А1 и А2 и обладает антитромботическими свойствами. Кроме того, дефибротид оказывает модулирующие влияние на эндотелий путем различных механизмов:
1) увеличение продукции PGI2 и PGE2;
2) ингибирование синтеза лейкотриена В4 (LTB4), обладающего протромботическими свойствами;
3) стимуляция фибринолиза вследствие ингибирования экспрессии PAI-1 и увеличения продукции t-PA;
4) уменьшение экспрессии ЕТ-1;
5) подавление системного воспалительного ответа путем ингибирования продукции цитокинов.
Важно, что при применении дефибротида содержание цитокинов возвращается к норме, тогда как при применении антагонистов TNF-a оно может снизиться до субминимальных значений, что может быть опасным у пациентов с мультиорганной недостаточностью. Кроме того, при применении антагонистов TNF-a выявляется статистически значимое повышение уровня антикардиолипиновых IgG и IgM. Несмотря на то, что повышение уровня аКЛ не ассоциируется с увеличением числа тромботических осложнений, полностью исключить возможность их развития нельзя. Хотя в литературе приводится только одно описание применения дефибротида при КАФС, использование данного препарата представляется патогенетически обоснованным в связи с ведущей ролью эндотелиальной дисфункции при КАФС и может быть весьма перспективным для терапии этого угрожающего состояния.
Случаев применения антицитокиновой терапии (инфликсимаб, анакинра, этанерсепт) не описано, однако, возможно, применение aнти-TNF-a-терапии может быть эффективно в связи с наличием ССВО и у пациентов с КАФС. По мнению Еrкаn D. и соавт. (2003) [19], применение антагонистов TNF-a показано при наличии развернутой картины ССВО, например при ОРДС.
Описано успешное применение у пациента с КАФС антител к CD-20 – ритуксимаба. Применение ритуксимаба при КАФС, рефрактерном к стандартной терапии, привело к быстрому улучшению состояния и восстановлению количества тромбоцитов.
Теоретически возможно применение и других антикоагулянтных препаратов (дипиридамол, тиклопидин, клопидогрел, гирудин, лепирудин, аргатробан), однако на практике они не были испытаны у пациентов с КАФС. Так, гирудин является наиболее мощным естественным ингибитором тромбина и особенно эффективен для лечения ГИТ.
Важная роль отводится и неспецифической терапии, направленной на борьбу с проявлениями системного воспалительного ответа и мультиорганной недостаточности. При почечной недостаточности требуется проведение гемодиализа, ИВЛ – в случае дыхательной недостаточности, наиболее часто обусловленной развитием ОРДС, инотропная поддержка при нестабильной гемодинамике, антигипертензивная терапия в случае гипертензии, которая нередко выявляется при тромбозе почечных артерий и вен или при ТМА и требует агрессивной гипотензивной терапии. В случае гипотензии, связанной с развитием на фоне ССВО при дисфункции миокарда, микроангиопатии мелких сосудов миокарда, инфаркта надпочечников, для инотропной поддержки показано применение глюкокортикоидов. У пациентов, находящихся на ИВЛ и получающих антикоагулянты, для профилактики осложнений со стороны желудочно-кишечного тракта рекомендуется назначения блокаторов Н2-рецептоов гистамина или ингибиторов протоновой помпы.
Пути профилактики КАФС
С целью профилактики КАФС в периоперационном периоде рекомендуется:
– свести к минимуму период, в течение которого приостанавливается антикоагулянтная терапия;
– при отсутствии хирургических противопоказаний как можно раньше возобновить антикоагулянтную терапию в послеоперационном периоде, учитывая то, что у пациентов с АФС возможно развитие тромбозов, несмотря на применение стандартных адекватных схем антикоагулянтной терапии;
– применять антикоагулянты в дозах, выше стандартных, так как у пациентов с АФС последние могут быть недостаточно эффективными;
– обеспечить эластическую компрессию для предупреждения явлений стаза в дистальных участках сосудистого русла.
В период отмены непрямых антикоагулянтов необходимо парентеральное введение антикоагулянтов, предпочтительно низкомолекулярного гепарина, в адекватных дозах. Кроме того, необходимо внимательно относиться к лечению любого инфекционного заболевания, применяя адекватную антибиотикотерапию. Следует также помнить, что при АФС категорически противопоказано применение оральных контрацептивов и заместительной гормональной терапии.
Безусловно, в акушерской практике сохранение беременности при наличии в анамнезе КАФС с развитием полиорганной недостаточности представляет большой риск. Однако на основании нашего опыта мы можем утверждать, что патогенетическая терапия с применением низкомолекулярного гепарина позволяет избежать осложнений беременности у пациентов с крайне тяжело протекающим АФС.
На сегодняшний день важной остается проблема диагностики КАФС, которая немыслима без определения АФА. Исходя из классификационых критериев КАФС, вероятная форма КАФС присутствует при преэклампсии, гнойно-септических заболеваниях, хориоамнионите, септическом шоке и критических состояниях в акушерской практике. Поэтому, выявление АФА должно быть обязательным у всех беременных с гестозами, привычным невынашиванием, начальными проявлениями гнойно-септических заболеваний. Проблема диагностики заключается в том, что вышеназванные состояния возникают внезапно, и для правильной диагностики и понимания патогенеза нет времени для проведения серологических методов исследования. Поэтому было бы крайне желательным определение антифосфолипидных антител во всех группах риска заранее. Это имеет огромное клиническое значение, так как преэклампсия, септический шок, тромбозы и другие критические состояния с циркуляцией АФА – это практически различные, с точки зрения патогенеза, прогноза и исхода, состояния, сопровождающиеся микроциркуляторными повреждениями жизненно важных органов, в основе которых лежит микротромбоз. Кроме того, наличие АФА определяет резистентность к терапии и большой риск рецидива. Такие же изменения происходят и в плаценте. Поэтому клиника и морфология безаппеляционно указывает на присутствие в данных случаях КАФС. Имеет ли это значение для практики? Безусловно. Это меняет терапию. Это объясняет необходимость профилактики в группах риска, более широкое использование плазмафереза с замещением плазмы. Наконец, это объясняет и высочайший риск летальных исходов при вышеназванных патологических состояниях, несмотря на «героическую», но не патогенетическую терапию.
У всех беременных с АФС и наследственной тромбофилией наиболее целесообразной является ранняя патогенетическая противотромботическая и противовоспалительная терапия с применением НМГ как во время беременности, так и минимум в течение 6 нед. после родов. Указанный подход позволяет осуществить профилактику потерь плода и тромботических осложнений, обеспечить более адекватное развитие плаценты, провести профилактику развития внутриутробной задержки роста плода, а также предотвратить развитие самого грозного осложнения АФС – катастрофической формы АФС. Своевременная диагностика КАФС позволит назначить адекватную терапию с применением НМГ, свежезамороженной плазмы, плазмафереза и избежать необоснованных и зачастую неэффективных вмешательств (экстирпация матки и т.д.).
Литература:
1. Баркаган З.С., Момот А.П., Сердюк Г.В. Основы диагностики и терапии антифосфолипидного синдрома. М. 2003; 48 с.
2. Долгушина Н.В., Макацария А.Д. Вирусные инфекции у беременных: Руководство для врачей. М. 2004; 144 с.
3. Лыдина И.В. Опыт использования бемипарина натрия для повышения результативности экстракорпорального оплодотворения. Тромбоз, гемостаз и реология. 2012; 4 (52).
4. Насонов Е.Л. Современные подходы к профилактике и лечению антифосфолипидного синдрома. Тер. Архив. 2003; 5: 83-87.
5. Насонов Е.Л. Антифосфолипидный синдром. М. 2004; 440 с.
6. Макацария А.Д., Бицадзе В.О., Баймурадова С.М., Долгушина Н.В., Юдаева Л.С., Хизроева Д.Х., Акиньшина С.В. Антифосфолипидный синдром – иммунная тромбофилия в акушерстве и гинекологии. М. 2007; 456 с.
7. Хизроева Д.Х. Антифосфолипидные антитела и тромботический шторм. Материалы XIII Всероссийского научного форума «Мать и Дитя». 2011; 213-214.
8. Asherson R.A. The catastrophic antiphospholipid syndrome. J Rheumatol. 1992;19: 508-512.
9. Asherson R.A. Multiorgan failure and antiphospholipid antibodies: the catastrophic antiphospholipid (Ashersons) syndrome. Immunobiology. 2005; 210: 727-733.
10. Asherson R.A., Cervera R., de Groot P.G., Erkan D., Boffa M.C., Piette J.C., Khamashta M.A., Shoenfeld Y. Catastrophic Antiphospholipid Syndrome Registry Project Group. Validation of the preliminary criteria for the classification of catastrophic antiphospholipid syndrome. Ann Rheum Dis. 2005; 64: 1205-1209.
11. Asherson R.A., Shoenfeld Y. The role of infection in the pathogenesis of catastrophic antiphospholipid syndrome--molecular mimicry? J Rheumatol. 2000; 27: 12-14.
12. Asherson R.A., Espinosa G., Cervera R. Disseminated intravascular coagulation in catastrophic antiphospholipid syndrome: clinical and haematological characteristics of 23 patients. Ann Rheum Dis. 2005; 64: 943-946.
13. Bashiri A., Burstein E., Mazor M. Cerebral palsy and fetal inflammatory response syndrome: a review. J Perinat Med. 2006; 34 (1): 5-12.
14. Bernard G.R., Vincent J.L., Laterre P.F., LaRosa S.P., Dhainaut J.F., Lopez-Rodriguez A., Steingrub J.S., Garber G.E., Helterbrand J.D., Ely E.W., Fisher C.J. Jr. Recombinant human protein C Worldwide Evaluation in Severe Sepsis (PROWESS) study group. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med. 2001 Mar 8; 344 (10): 699-709.
15. Brenner B., Hoffman R., Carp H., Dulitsky M., Younis J. Live-enox Investigators. Efficacy and safety of two doses of enoxaparin in women with thrombophilia and recurrent pregnancy loss: the Live-enox study. J Thromb Haemost. 2005; 3: 227-229.
16. Carmona F., Lazaro I., Reverter J.C., Tassies D., Font J., Cervera R., Balasch J. Impaired factor XIIa-dependent activation of fibrinolysis in treated antiphospholipid syndrome gestations developing late-pregnancy complications. Am J Obstet Gynecol. 2006; 194: 457-465.
17. Cruz M., Fernandez-Alonso A.M., Rodriges I. et al. Prevention of thrombotic complications after cesarean section using two different regimens bemiparin. Medical advice. 2012; 3-7.
18. de Groot P.G., Horbach D.A., Derksen R.H. Protein C and other cofactors involved in the binding of antiphospholipid antibodies: relation to the pathogenesis of thrombosis. Lupus. 1996; 5: 488-493.
19. Erkan D., Leibowitz E., Berman J., Lockshin M.D. Perioperative medical management of antiphospholipid syndrome: hospital for special surgery experience, review of literature, and recommendations. J Rheumatol. 2002 Apr; 29 (4): 843-9.
20. Gharavi A.E., Pierangeli S.S., Harris E.N. New developments in viral peptides and APL induction. J Autoimmun. 2000; 15: 227-230.
21. Haemotology. Clinical cases uncovered. 2009 by Shaun McCann, Robin Foa, Owen Smith, Eibhlin Conneally. Wiley-Blackwell. A John Wiley & Sons, Ltd., Publication. 190 p.
22. Hemostasis and Thrombosis in obstetrics and gynecology. 2011 by Michael J. Paidas, Nazli Hossain, Tahir S. Shamsi, Marc A. Rodger, Jens Langhoff-Roos, Charles J. Lockwood. Willey-Blackwell. 223 p.
23. Karmochkine M., Mazoyer E., Marcelli A., Boffa M.C., Piette J.C. High prevalence of antiphospholipid antibodies in disseminated intravascular coagulation. Thromb Haemost. 1996; 75: 971.
24. Katzav A., Evert T., Pick C.G., Blank M., Shoenfeld Y., Chapman J. Induction of antiphospholipid syndrome in Factor V Leiden mice. Immunobiology. 2005; 209: 10-11.
25. Kitchens C.S. Thrombotic storm: when thrombosis begets thrombosis. Am J Med. 1998; 104: 381-385.
26. Lai S., Walker D.H., Elghetany M.T. Catastrophic antiphospholipid syndrome: a rare cause of disseminated microvascular thrombotic injury – a case report with pathological and molecular correlative studies. Pathol Int. 2005; 55: 144-149.
27. Le Thi Thuong D., Tieulie N., Costedoat N., Andreu M.R., Wechsler B., Vauthier-Brouzes D., Aumaitre O., Piette J.C. The Hellp syndrome in the antiphospholipid syndrome: retrospective study of 16 cases in 15 women. Ann Rheum Dis. 2005; 64: 273-278.
28. Lu C.S., Horizon A.A., Hwang K.K., FitzGerald J., Lin W.S., Hahn B.H., Wallace D.J., Metzger A.L., Weisman M.H., Chen P.P. Identification of polyclonal and monoclonal antibodies against tissue plasminogen activator in the antiphospholipid syndrome. Arthritis Rheum. 2005; 52: 4018-4027.
29. Makatsariya A.D., Bitsadze V.O., Khizroeva J.K. Fetal thrombophilia and obstetrics complications. Pathophysiology of haemostasis and thrombosis. Proceeding and abstracts from the 19th International Congress on Thrombosis. Tel-Aviv, Israel, May 140-18, 2006; A10.
30. Makatsariya A.D., Asherson R.A., Bitsadze V.O., Akinshina S. Catastrophic antiphospholipid (Ashersons) syndrome and genetic thrombophilic disorders in obstetrics. Autoimmunity Reviews. 2006; Article in press.
31. Meves S.H, Overbeck U. Endres H.G., Kroguas C., Neubauer H. Dose-dependent effect of early antiplatelet therapy in acute ischaemic stroke. Thrombosis and Haemostasis. 2012; 107: 69-80.
32. Nelson S.M., Scott N., Ian A. Greer. The potential role of heparin in assisted conception. Human Reproduction Update. 2008; 14 (6): 623-645.
33. Raschi E., Testoni C., Bosisio D., Borghi M.O., Koike T., Mantovani A., Meroni P.L. Role of the MyD88 transduction signaling pathway in endothelial activation by antiphospholipid antibodies. Blood. 2003; 101: 3495-3500.
34. Shoenfeld Y. The infectious etiology of APS: Novel cross reactive epitopes on yeasts, bacteria and viruses. 2nd Tutzing Antiphospholipid Conference. Immunobiology. 2005; 209 (S1).
35. Ten Cate H. Pathophysiology of disseminated intravascular coagulation in sepsis. Crit Care Med. 2000; 28: 9-11.
36. The Catastrophic Antiphospholipid Syndrome (Ashersons Syndrome). Monograph. Collected papers; 1992-2005. Printed by Creda Communications. 112 p.
37. Wiedermann F.J., Mayr A., Schobersberger W., Knotzer H., Sepp N., Rieger M., Hasibeder W., Mutz N. Acute respiratory failure associated with catastrophic antiphospholipid syndrome. J Intern Med. 2000; 247: 723-730.
38. Vora S.K., Asherson R.A., Erkan D. Catastrophic antiphospholipid syndrome. J Intensive Care Med. 2006; 21: 144-159.
39. Villa J., Marco A., Santamaria A. et al. Haemostasis and Thrombosis Unit, Haematology Service. Gynaecology and Obstetrics Department, Hospital de la Santa Creu I Sant Pau, Barcelona, Spain. 2006. The 2nd International symposium Women’s health issues in thrombosis and Haemostasis. Budapest, Hungary, Feb 4-6, 2005.
40. Yasuda S., Atsumi T., Matsuura E., Kaihara K., Yamamoto D., Ichikawa K., Koike T. Significance of valine/leucine247 polymorphism of beta2-glycoprotein I in antiphospholipid syndrome: increased reactivity of anti-beta2-glycoprotein I autoantibodies to the valine 247 beta2-glycoprotein I variant. Arthritis Rheum. 2005 Jan; 52 (1): 212-8.
References:
1. Barkagan Z.S., Momot A.P., Serdyuk G.V. Basics of diagnostics and therapy of antiphospholipid syndrome. Moscow. 2003; 48. (In Russian).
2. Dolgushina N.V., Makatsaria A.D. Viral infections in pregnancy: A Guide for Physicians. Moscow, 2004; 144. (In Russian).
3. Lydina I.V. Experience in the use of bemiparin sodium to improve the efficiency of in vitro fertilization. Thrombosis, hemostasis and rheology. 2012; 4 (52). (In Russian).
4. Nasonov E.L. Modern approaches to prevention and treatment of antiphospholipid syndrome. Ter. Archive. 2003; 5: 83-87. (In Russian).
5. Nasonov E.L. Antiphospholipid syndrome. Moscow. 2004; 440. (In Russian).
6. Makatsariya A.D., Bitsadze V.O., Baimuradova S.M., Dolgushina N.V., Yudaeva L.S., Khizroeva D.Kh., Akinshina S.V. Antiphospholipid syndrome – the immune thrombophilia in obstetrics and gynecology. Moscow. 2007; 456 s. (In Russian).
7. Hizroeva D.H. Antiphospholipid antibodies and thrombotic storm. Proceedings of XIII All-Russian Scientific Forum "Mother and Child". 2011; 213-214. (In Russian).
8. Asherson R.A. The catastrophic antiphospholipid syndrome. J Rheumatol. 1992;19: 508-512.
9. Asherson R.A. Multiorgan failure and antiphospholipid antibodies: the catastrophic antiphospholipid (Ashersons) syndrome. Immunobiology. 2005; 210: 727-733.
10. Asherson R.A., Cervera R., de Groot P.G., Erkan D., Boffa M.C., Piette J.C., Khamashta M.A., Shoenfeld Y. Catastrophic Antiphospholipid Syndrome Registry Project Group. Validation of the preliminary criteria for the classification of catastrophic antiphospholipid syndrome. Ann Rheum Dis. 2005; 64: 1205-1209.
11. Asherson R.A., Shoenfeld Y. The role of infection in the pathogenesis of catastrophic antiphospholipid syndrome--molecular mimicry? J Rheumatol. 2000; 27: 12-14.
12. Asherson R.A., Espinosa G., Cervera R. Disseminated intravascular coagulation in catastrophic antiphospholipid syndrome: clinical and haematological characteristics of 23 patients. Ann Rheum Dis. 2005; 64: 943-946.
13. Bashiri A., Burstein E., Mazor M. Cerebral palsy and fetal inflammatory response syndrome: a review. J Perinat Med. 2006; 34 (1): 5-12.
14. Bernard G.R., Vincent J.L., Laterre P.F., LaRosa S.P., Dhainaut J.F., Lopez-Rodriguez A., Steingrub J.S., Garber G.E., Helterbrand J.D., Ely E.W., Fisher C.J. Jr. Recombinant human protein C Worldwide Evaluation in Severe Sepsis (PROWESS) study group. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med. 2001 Mar 8; 344 (10): 699-709.
15. Brenner B., Hoffman R., Carp H., Dulitsky M., Younis J. Live-enox Investigators. Efficacy and safety of two doses of enoxaparin in women with thrombophilia and recurrent pregnancy loss: the Live-enox study. J Thromb Haemost. 2005; 3: 227-229.
16. Carmona F., Lazaro I., Reverter J.C., Tassies D., Font J., Cervera R., Balasch J. Impaired factor XIIa-dependent activation of fibrinolysis in treated antiphospholipid syndrome gestations developing late-pregnancy complications. Am J Obstet Gynecol. 2006; 194: 457-465.
17. Cruz M., Fernandez-Alonso A.M., Rodriges I. et al. Prevention of thrombotic complications after cesarean section using two different regimens bemiparin. Medical advice. 2012; 3-7.
18. de Groot P.G., Horbach D.A., Derksen R.H. Protein C and other cofactors involved in the binding of antiphospholipid antibodies: relation to the pathogenesis of thrombosis. Lupus. 1996; 5: 488-493.
19. Erkan D., Leibowitz E., Berman J., Lockshin M.D. Perioperative medical management of antiphospholipid syndrome: hospital for special surgery experience, review of literature, and recommendations. J Rheumatol. 2002 Apr; 29 (4): 843-9.
20. Gharavi A.E., Pierangeli S.S., Harris E.N. New developments in viral peptides and APL induction. J Autoimmun. 2000; 15: 227-230.
21. Haemotology. Clinical cases uncovered. 2009 by Shaun McCann, Robin Foa, Owen Smith, Eibhlin Conneally. Wiley-Blackwell. A John Wiley & Sons, Ltd., Publication. 190 p.
22. Hemostasis and Thrombosis in obstetrics and gynecology. 2011 by Michael J. Paidas, Nazli Hossain, Tahir S. Shamsi, Marc A. Rodger, Jens Langhoff-Roos, Charles J. Lockwood. Willey-Blackwell. 223 p.
23. Karmochkine M., Mazoyer E., Marcelli A., Boffa M.C., Piette J.C. High prevalence of antiphospholipid antibodies in disseminated intravascular coagulation. Thromb Haemost. 1996; 75: 971.
24. Katzav A., Evert T., Pick C.G., Blank M., Shoenfeld Y., Chapman J. Induction of antiphospholipid syndrome in Factor V Leiden mice. Immunobiology. 2005; 209: 10-11.
25. Kitchens C.S. Thrombotic storm: when thrombosis begets thrombosis. Am J Med. 1998; 104: 381-385.
26. Lai S., Walker D.H., Elghetany M.T. Catastrophic antiphospholipid syndrome: a rare cause of disseminated microvascular thrombotic injury – a case report with pathological and molecular correlative studies. Pathol Int. 2005; 55: 144-149.
27. Le Thi Thuong D., Tieulie N., Costedoat N., Andreu M.R., Wechsler B., Vauthier-Brouzes D., Aumaitre O., Piette J.C. The Hellp syndrome in the antiphospholipid syndrome: retrospective study of 16 cases in 15 women. Ann Rheum Dis. 2005; 64: 273-278.
28. Lu C.S., Horizon A.A., Hwang K.K., FitzGerald J., Lin W.S., Hahn B.H., Wallace D.J., Metzger A.L., Weisman M.H., Chen P.P. Identification of polyclonal and monoclonal antibodies against tissue plasminogen activator in the antiphospholipid syndrome. Arthritis Rheum. 2005; 52: 4018-4027.
29. Makatsariya A.D., Bitsadze V.O., Khizroeva J.K. Fetal thrombophilia and obstetrics complications. Pathophysiology of haemostasis and thrombosis. Proceeding and abstracts from the 19th International Congress on Thrombosis. Tel-Aviv, Israel, May 140-18, 2006; A10.
30. Makatsariya A.D., Asherson R.A., Bitsadze V.O., Akinshina S. Catastrophic antiphospholipid (Ashersons) syndrome and genetic thrombophilic disorders in obstetrics. Autoimmunity Reviews. 2006; Article in press.
31. Meves S.H, Overbeck U. Endres H.G., Kroguas C., Neubauer H. Dose-dependent effect of early antiplatelet therapy in acute ischaemic stroke. Thrombosis and Haemostasis. 2012; 107: 69-80.
32. Nelson S.M., Scott N., Ian A. Greer. The potential role of heparin in assisted conception. Human Reproduction Update. 2008; 14 (6): 623-645.
33. Raschi E., Testoni C., Bosisio D., Borghi M.O., Koike T., Mantovani A., Meroni P.L. Role of the MyD88 transduction signaling pathway in endothelial activation by antiphospholipid antibodies. Blood. 2003; 101: 3495-3500.
34. Shoenfeld Y. The infectious etiology of APS: Novel cross reactive epitopes on yeasts, bacteria and viruses. 2nd Tutzing Antiphospholipid Conference. Immunobiology. 2005; 209 (S1).
35. Ten Cate H. Pathophysiology of disseminated intravascular coagulation in sepsis. Crit Care Med. 2000; 28: 9-11.
36. The Catastrophic Antiphospholipid Syndrome (Ashersons Syndrome). Monograph. Collected papers; 1992-2005. Printed by Creda Communications. 112 p.
37. Wiedermann F.J., Mayr A., Schobersberger W., Knotzer H., Sepp N., Rieger M., Hasibeder W., Mutz N. Acute respiratory failure associated with catastrophic antiphospholipid syndrome. J Intern Med. 2000; 247: 723-730.
38. Vora S.K., Asherson R.A., Erkan D. Catastrophic antiphospholipid syndrome. J Intensive Care Med. 2006; 21: 144-159.
39. Villa J., Marco A., Santamaria A. et al. Haemostasis and Thrombosis Unit, Haematology Service. Gynaecology and Obstetrics Department, Hospital de la Santa Creu I Sant Pau, Barcelona, Spain. 2006. The 2nd International symposium Women’s health issues in thrombosis and Haemostasis. Budapest, Hungary, Feb 4-6, 2005.
40. Yasuda S., Atsumi T., Matsuura E., Kaihara K., Yamamoto D., Ichikawa K., Koike T. Significance of valine/leucine247 polymorphism of beta2-glycoprotein I in antiphospholipid syndrome: increased reactivity of anti-beta2-glycoprotein I autoantibodies to the valine 247 beta2-glycoprotein I variant. Arthritis Rheum. 2005 Jan; 52 (1): 212-8.
Сведения об авторах:
Бицадзе Виктория Омаровна – д.м.н., профессор, профессор кафедры акушерства и гинекологии медико-профилактического факультета Первого МГМУ им. И.М. Сеченова. Адрес: ул. Земляной Вал, 62, стр. 1, Москва, Россия, 109004. Тел.: +7 (495) 788-58-40. E-mail: gemostasis@mail.ru.
Хизроева Джамиля Хизриевна – к.м.н., ассистент кафедры акушерства и гинекологии медико-профилактического факультета Первого МГМУ им. И.М. Сеченова. Адрес: ул. Земляной Вал, 62, стр. 1, Москва, Россия, 109004. Тел.: +7 (495) 788-58-40. E-mail: gemostasis@mail.ru.
Идрисова Лариса Эмиевна – к.м.н., научный сотрудник кафедры акушерства и гинекологии медико-профилактического факультета Первого МГМУ им. И.М. Сеченова. Адрес: ул. Земляной Вал, 62, стр. 1, Москва, Россия, 109004. Тел.: +7 (495) 788-58-40. E-mail: gemostasis@mail.ru.
Абрамян Рузанна Размиковна – научный сотрудник Ереванского Научно-Исследовательского Института Акушерства, перинатологии и гинекологии, кандидат медицинских наук кафедры акушерства и гинекологии медико-профилактического факультета Первого МГМУ им. И.М. Сеченова. Адрес: ул. Земляной Вал, 62, стр. 1, Москва, Россия, 109004. Тел.: +7 (495) 788-58-40. E-mail: r_abrahamyan@mail.ru.
Андреева Маргарита Дарчоевна – к.м.н., доцент кафедры акушерства, гинекологии и перинатологии ФПК и ППС Кубанского государственного медицинского университета. Адрес: ул. Седина, 4, Краснодар, 350063, Россия. Тел.: +78612220114. Е-mail: andreeva_md@mail.ru.
Макацария Александр Давидович – д.м.н., член-корреспондент РАН, профессор, заведующий кафедрой акушерства и гинекологии медико-профилактического факультета Первого МГМУ им. И.М. Сеченова. Адрес: ул. Земляной Вал, 62, стр. 1, Москва, Россия, 109004. Тел.: +7 (495) 788-58-40. E-mail: gemostasis@mail.ru.
About the authors:
Bitsadze Victoria Omarovna – MD., Professor, Department of Obstetrics and Gynecology, Faculty of Medical and Preventive, First Moscow State Medical Sechenov University. Address: ul. Zemlyanoi Val, 62-1, Moscow, Russia, 109004. Tel.: +7 (495) 788-58-40. E-mail: gemostasis@mail.ru.
Khizroeva Dzhamilya Khizrievna – PhD, Department of Obstetrics and Gynecology, Faculty of Medical and Preventive, First Moscow State Medical Sechenov University. Address: ul. Zemlyanoi Val, 62-1, Moscow, Russia, 109004. Tel.: +7 (495) 788-58-40. E-mail: gemostasis@mail.ru.
Idrisova Larisa Emievna – PhD, researcher at the Department of of Obstetrics and Gynecology Department, First Moscow State Medical Sechenov University. Address: ul. Zemlyanoi Val, 62-1, Moscow, Russia, 109004. Tel.: +7 (495) 788-58-40. E-mail: gemostasis@mail.ru.
Abramyan Ruzanna Razmikovna – Researcher of the Yerevan Scientific Research Institute of Obstetrics, Gynecology and Perinatology, PhD, Department of Obstetrics and Gynecology, Faculty of Medical and Preventive, First Moscow State Medical Sechenov University. Address: ul. Zemlyanoi Val, 62-1, Moscow, Russia, 109004. Tel.: +7 (495) 788-58-40. E-mail: r_abrahamyan@mail.ru
Andreeva Margarita Darchoevna – the Chair of Obstetrics, Gynecology and Perinatolology of the Faculty of Post-educational Training and Improvemet of Proffessional Skills of State Educational Institution of the Higher Professional Education “Kuban State Medical University” of Minisry of Health of the Russian Federation. Address: Sedin Str., 4, Krasnodar, 350063, Russia. Тел.: +78612220114. Е-mail: andreeva_md@mail.ru
Makatsariya Aleksandr Davidovich – MD, corresponding member of the Russian Academy of Sciences, Professor, Head of the Department of Obstetrics and Gynecology, Faculty of Medical and Preventive, First Moscow State Medical Sechenov University. Address: ul. Zemlyanoi Val, 62-1, Moscow, Russia, 109004. Tel.: +7 (495) 788-58-40. E-mail: gemostasis@mail.ru.
|