ПАТОГЕНЕТИЧЕСКАЯ РОЛЬ ТРОМБОФИЛИИ В РАЗВИТИИ ТЯЖЕЛЫХ ФОРМ ГЕСТОЗА
Атабаева Х.Л. Дата публикации на сайте: 2014-05-15 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
В статье изложены материалы обследования беременных с тяжелыми формами гестоза, у которых проводился анализ на наличие генетических форм тромбофилии. Дается научное обоснование необходимости противотромботической профилактики низкомолекулярными гепаринами.
PATHOGENETIC ROLE OF THROMBOPHILIA IN PREECLAMPSIA DEVELOPMENT
Atabaeva Kh.L.
The State Education Institution of Higher Professional Training The First Sechenov Moscow State Medical University under Ministry of Health of the Russian Federation
Abstract: the article describes the examination data of pregnant women with severe preeclampsia, which were analyzed for the presence of genetic thrombophilia. Reviewed approaches to prevention of obstetrics complication and antithrombotic prophylaxis with LMWH.
Key words: thrombophilia, pathogenesis of thrombotic complications, thrombosis prevention, preeclampsia, complicated pregnancy
Ключевые слова: тромбофилия, патогенез тромботических осложнений, профилактика тромбозов, гестоз, осложненная беременность.
Гестоз является тяжелейшим осложнением беременности и остается одной из главных причин материнской и перинатальной заболеваемости и смертности [2,9].
Несмотря на то, что частота гестоза растет и этой проблеме уделяется пристальное внимание во всем мире, глобальных изменений в лечении тяжелых форм гестоза не произошло [1]. Также остается неясной и причина возникновения гестоза. Открытие генетически обусловленной тромбофилии дало новую возможность подхода к проблеме гестоза благодаря данным о том, что тромбофилия тесно связана с такими распространенными формами акушерской патологии, как синдром потери плода, гестозы, ПОНРП [3,5,8,9].
По данным многих исследователей во всем мире, новая эра в понимании этиопатогенеза гестоза началась с открытия новых наиболее часто встречающихся в общей популяции генетических дефектов гемостаза тромбофилического характера и антифосфолипидного синдрома, а также установления роли тромбофилии в патологии процессов имплантации плодного яйца, плацентации и более поздних нарушений маточноплацентарной перфузии [8,9]. Таким образом, тромбофилия может рассматриваться как важнейший этиопатогенетический фактор развития гестоза. Физиологически протекающая беременность сама по себе сопровождается состоянием гиперкоагуляции, но дополнительная гиперкоагуляция на фоне таких факторов, как мутации FVLelden, MTHFRC677T, PtG20210A, приводит к возникновению различных форм акушерской патологии [4,6,11]. Тромбофилия способствует развитию эндотелиопатии. При повреждении эндотелия сосудов комплексами АФА, гомоцистеином и продуктами его метаболизма уменьшается выработка естественных антикоагулянтов с усилением прокоагулянтов, что приводит к возрастанию уровня фактора Виллебранда и фибронектина, которые, в свою очередь, являются одновременными компонентами ДВС-синдрома и гестоза [3,7]. Выраженность клинических проявлений гестоза может зависеть от вида и формы мутации. Гипергомоцистеинемия является значительным независимым фактором риска возникновения тромбоза, развития гестоза, гипертензии при беременности, ПОНРП и внутриутробной задержки развития плода [10]. Риск возникновения гестоза значительно возрастает при сочетании генетически обусловленной тромбофилии с АФС [5,8,12].
В связи с этим представляет интерес молекулярное исследование генетических форм тромбофилии у пациенток с тяжелыми формами гестоза.
Материалы и методы
Нами было обследовано 65 женщин: 35 составили I группу – беременные, имеющие повторные тяжелые формы гестоза в настоящую беременность. Во II груп-пу вошли 30 первобеременных женщин с тяжелыми формами гестоза. 20 соматически здоровых женщин с физиологическим течением беременности составили контрольную группу.
Были изучены следующее показатели лабораторных тестов: маркеры тромбофилии – Д-димер, комплексы TAT. ПЦР-исследование – определение мутации FV Leiden, мутации протромбина G20210A, полиморфизм гена PAI-1 G4/G5, мутация гена MTHFR C677T, полиморфизм генов тромбоцитарных гликопротеинов: GP IIb/IIIa, GP Ia/IIa, GPIbα, GP ADP.
Результаты обследования
Различные формы генетической тромбофилии были обнаружены у всех пациенток, вошедших в I группу.
Во II группе частота обнаружения различных форм тромбофилии составила 53,33%, в контрольной группе генетическая тромбофилия была обнаружена у 25% обследованных женщин. Спектр обнаруженных форм тромбофилии представлен на рисунке 1.
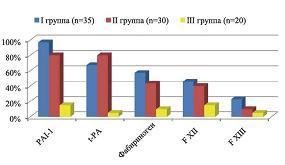 | Рисунок 1: Спектр генетических форм тромбофилии. |
В фертильном цикле и с наступлением беременности женщинам рекомендовалось проведение инъекций низкомолекулярного гепарина (НМГ) – надропарина кальция в профилактической дозе от 0,3 до 0,6 мл, эноксапарана натрия (20-60 мг) или дальтепарина натрия (2500 – 5000 МЕ). НМГ назначались в непрерывном режиме в течение всей беременности. Для выбора исходно адекватной дозы и контроля эффективности и безопасности применения препаратов всем пациенткам до назначения терапии, а затем через 10 дней и далее ежемесячно проводился контроль уровня маркеров тромбофилии (РКМФ, Д-димера), определялась агрегационная активность тромбоцитов, а также вычислялись значения МНО по данным глобального теста оценки функции протеина С («Парус»-тест).
Для профилактики развития гепарининдуцированной тромбоцитопении (ГИТ) проводился подсчет количества тромбоцитов до назначения препарата и на 5, 10 и 15-е сутки терапии. Ни в одном случае признаков ГИТ не выявлено.
Положительная динамика через две недели противотромботической терапии была отмечена у 30 пациенток I группы и 25 пациенток II группы. У пяти пациенток I группы и пяти пациенток II группы отмечалось прогрессирование гестоза, в связи с чем они были родоразрешены путем операции кесарева сечения в сроке 32-36 недель беременности.
В I группе у 30 (85,7%) произошли срочные роды. Из них 9 (25,71%) были родоразрешены путем операции кесарева сечения, 21 (60%) – через естественные родовые пути. Из 30 женщин II группы у 25 (83,33%) произошли срочные роды, пять (16,67%) пациенток были родоразрешены в сроке 32-36 недель беременности. 15 (60%) из 25 пациенток были родоразрешены путем операции кесарево сечения, 10 (40%) – через естественные родовые пути.
Заключение
Таким образом, нам удалось показать, что патогенетическая профилактика повторных тяжелых гестозов должна быть основана на профилактике проявлений провоспалительного статуса и генетической тромбофилии. У женщин, имевших в анамнезе тяжелый гестоз, выявляется высокая частота полиморфизмов провоспалительных цитокинов и генетической тромбофилии. При этом определение уровня Д-димера позволяет контролировать эффективность как антикоагулянтной, так и терапии провоспалительного статуса.
Литература:
1. Абаева И.Ш. Клиническое значение контроля за маркерами воспаления у беременных с синдромом потери плода и тромбофилией. Автореферат дис. канд. мед. наук. М. 2011; 23 с.
2. Бицадзе В.О. Патогенез, принципы диагностики и профилактики осложнений беременности, обусловленных тромбофилией. Дисс. …докт. мед. наук. М., 2004.
3. Бицадзе В.О, Макацария А.Д., Хизроева Д.Х. и др. Тромбофилия как важнейшее звено патогенеза осложнений беременности. Практическая медицина. 2012; 5: 22-29.
4. Гадаева З.К. Частота и спектр полиморфизмов провоспалительных цитокинов и тромбофилии у беременных с метаболическим синдромом и гестозом. Материалы X юбилейного Всероссийского научного форума Мать и Дитя. М. 2009; 42 с.
5. Дубоссарская З.М., Дука Ю.М. Место тромбофилии в структуре синдрома потери плода. Таврический медико-биологический вестник. 2011; 14 (3; 1); 75-77.
6. Макацария А.Д., Бицадзе В.О. Тромбофилии и противотромботическая терапия в акушерской практике. М. 2003; 904 с.
7. Bick R.L. Recurrent miscarriage syndrome due to blood coagulation protein/platelet defects: prevalence, treatment and outcome results. DRW Metroplex Recurrent Miscarriage Syndrome Cooperative Group. Clin. Appl. Thromb. Hemost. 2000 Jul; 6 (3): 115-25.
8. Brenner B. Thrombophilia and pregnancy. Clin. Adv. Hematol. Oncol. 2003 Jun; 1 (6): 351-5.
9. Goodlin R. С Preeclampsia as the great impostor. Amer. J. Obstet. Gynec. 1991; 164: 1577-81.
10. Karpman D., Tati R. Complement activation in thrombotic microangiopathy. Hamostaseologie. 2013 May 29; 33 (2): 96-104.
11. Mazhar S.B., Emanuel A. Haematological defects in recurrent pregnancy loss. Haematology Updates. 2011: 56-60.
12. McCrae K.R., Cines D.B.Thrombotic microangiopathy during pregnancy. Seminhematol. 1997; 34 (2): 148-58.
References:
1. Abaeva I.Sh. Klinicheskoe znachenie kontrolja za markerami vospalenija u beremennyh s sindromom poteri ploda i trombofiliej. Avtoreferat dis. kand. med. nauk. M. 2011; 23 s.
2. Bicadze V.O. Patogenez, principy diagnostiki i profilaktiki oslozhnenij beremennosti, obuslovlennyh trombofiliej. Diss. …dokt. med. nauk. M., 2004.
3. Bicadze V.O, Makacarija A.D., Hizroeva D.H. i dr. Trombofilija kak vazhnejshee zveno patogeneza oslozhnenij beremennosti. Prakticheskaja medicina. 2012; 5: 22-29.
4. Gadaeva Z.K. Chastota i spektr polimorfizmov provospalitelnyh citokinov i trombofilii u beremennyh s metabolicheskim sindromom i gestozom. Materialy X jubilejnogo Vserossijskogo nauchnogo foruma Mat i Ditja. M. 2009; 42 s.
5. Dubossarskaja Z.M., Duka Ju.M. Mesto trombofilii v strukture sindroma poteri ploda. Tavricheskij mediko-biologicheskij vestnik. 2011; 14 (3; 1); 75-77.
6. Makacarija A.D., Bicadze V.O. Trombofilii i protivotromboticheskaja terapija v akusherskoj praktike. M. 2003; 904 s.
7. Bick R.L. Recurrent miscarriage syndrome due to blood coagulation protein/platelet defects: prevalence, treatment and outcome results. DRW Metroplex Recurrent Miscarriage Syndrome Cooperative Group. Clin. Appl. Thromb. Hemost. 2000 Jul; 6 (3): 115-25.
8. Brenner B. Thrombophilia and pregnancy. Clin. Adv. Hematol. Oncol. 2003 Jun; 1 (6): 351-5.
9. Goodlin R. С Preeclampsia as the great impostor. Amer. J. Obstet. Gynec. 1991; 164: 1577-81.
10. Karpman D., Tati R. Complement activation in thrombotic microangiopathy. Hamostaseologie. 2013 May 29; 33 (2): 96-104.
11. Mazhar S.B., Emanuel A. Haematological defects in recurrent pregnancy loss. Haematology Updates. 2011: 56-60.
12. McCrae K.R., Cines D.B.Thrombotic microangiopathy during pregnancy. Seminhematol. 1997; 34 (2): 148-58.
PATHOGENETIC ROLE OF THROMBOPHILIA IN PREECLAMPSIA DEVELOPMENT
Atabaeva Kh.L.
The State Education Institution of Higher Professional Training The First Sechenov Moscow State Medical University under Ministry of Health of the Russian Federation
Abstract: the article describes the examination data of pregnant women with severe preeclampsia, which were analyzed for the presence of genetic thrombophilia. Reviewed approaches to prevention of obstetrics complication and antithrombotic prophylaxis with LMWH.
Key words: thrombophilia, pathogenesis of thrombotic complications, thrombosis prevention, preeclampsia, complicated pregnancy. |
|