ЗНАЧЕНИЕ ОЦЕНКИ СИСТЕМЫ ГЕМОСТАЗА ДЛЯ ОПРЕДЕЛЕНИЯ ТАКТИКИ ВЕДЕНИЯ БЕРЕМЕННОСТИ У ПАЦИЕНТОК С ИШЕМИЧЕСКИМ ИНСУЛЬТОМ В АНАМНЕЗЕ
Акиньшина С.В., Макацария А.Д., Бицадзе В.О. Дата публикации на сайте: 2014-05-15 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
В настоящее время в связи со снижением частоты прямых акушерских причин материнской смертности все больший интерес ученых вызывают артериальные тромботические осложнения. Среди артериальных тромбозов наиболее частым и драматичным по своим последствиям у женщин детородного возраста является ишемический инсульт. Патогенез столь тяжелого осложнения у молодых женщин до конца не изучен, однако существует концепция ведущей роли тромбоза или эмболии сосудов головного мозга, которые могут развиваться на фоне таких хорошо известных общепопуляционных факторов риска, как артериальная гипертензия, метаболический синдром, курение, нарушения сердечного ритма, заболевания клапанов сердца, а также при типично акушерских патологиях, например, на фоне преэклампсии, массивных кровотечений, септических осложнений, эмболии околоплодными водами. В последние годы все больший интерес проявляется к изучению роли тромбофилий в патогенезе ишемических инсультов, однако данные по этому вопросу еще более ограничены и противоречивы, чем для венозных тромбозов. Кроме того, открытым остается вопрос о тактике ведения беременности у пациенток с перенесенным ишемическим инсультом.
Pregnancy in women with history of ischemic stroke and thrombophilia
State Federal-Funded Educational Institution of Higher Vocational Training I.M. Sechenov First Moscow State Medical University of the Ministry of Health of the Russian Federation
Akinshina S.V., Makatsariya A.D., Bitsadze V.O.
Abstract: currently due to reduction of direct causes of maternal mortality increasing interest of scientists cause arterial thrombotic complications. Pregnancy-related stroke is a rare event, however, when it occurs, may be life threatening and there may be implications for management of the patient and delivery. The mechanisms and risk factors for ischemic stroke related to pregnancy and in women of childbearing age remain unclear. Pathogenesis of so severe complication in young women is not fully understood, however, there is a concept thrombosis or cerebral embolism, which can develop on the background of well-known population-based risk factors such as hypertension, metabolic syndrome, smoking, heart rhythm disorders, valvular heart disease or in relation to typical obstetric pathologies, such as preeclampsia, massive obstetrical bleeding, septic complications, amniotic fluid embolism. In recent years, there is increasing interest in the role of thrombophilia in the pathogenesis of ischemic stroke, however, data on this issue is even more limited and contradictory than for venous thrombosis. Methods of prevention of recurrent stroke and strategies of pregnancy and delivery management in women with history of ischemic stroke are also contradictory.
Key words: ischemic stroke, pregnancy, thrombophilia, antiphospholipid syndrome, low molecular weight heparin.
Ключевые слова: ишемический инсульт, беременность, тромбофилия, антифосфолипидный синдром, низкомолекулярный гепарин.
ГБОУ ВПО «Первый МГМУ имени И.М. Сеченова» Минздрава РФ, Москва
Эпидемиология острых нарушений мозгового кровообращения у женщин репродуктивного возраста
Эпидемиологические данные свидетельствуют о том, что у лиц в возрасте до 35 лет риск инсульта выше у женщин, чем у мужчин, при этом для женщин характерны и более тяжелые последствия этого осложнения, включая риск фатального исхода и инвалидизации [15,45]. Инсульт во время беременности является достаточно редким явлением и развивается, по разным данным, с частотой от 4,2 до 210 на 100 000 родов, однако считается тяжелейшим осложнением, при котором летальность может достигать 8-26% [50,9]. Приблизительно от 12 до 35% случаев инсультов у лиц в возрасте от 15 до 45 лет связано с беременностью [24,25]. Беременность даже называют «спонтанным скрининговым тестом на риск раннего инсульта» [6]. При беременности отмечается повышение риска инсульта в 3-13 раз [22], однако, в связи с ограниченным числом исследований, посвященным данному вопросу, и включением в них небольшого количества пациенток проведение точного статистического анализа крайне затруднено. Ряд авторов указывают на примерно равное повышение риска геморрагических и ишемических инсультов, связанных с беременностью [50]. В большинстве случаев (до 90%) инсульт развивается в III триместре беременности и в послеродовом периоде [45]. По данным исследования Kittner S.J. (1996), риск ишемического инсульта в послеродовом периоде повышается в 5 раз по сравнению с небеременными пациентками того же возраста (ОР 5,4, 95% ДИ 2,9-10,0), а риск геморрагического инсульта – в 18 раз (ОР 18,2, 95% ДИ 8,7-38,1) [24]. Следует отметить, что риск инсульта остается повышенным в течение достаточно продолжительного периода времени после родов [50,44]. Tang C.H. и соавт. (2009), проанализировав 139 геморрагических и 107 ишемических инсультов, связанных с беременностью, установили, что относительный риск этих осложнений у пациенток с преэклампсией составляет соответственно 10,7 и 40,9 в течение III триместра беременности, 6,5 и 34,7 – в течение трех дней после родов, 5,6 и 11,2 – с 3-го дня до 6 недель после родов, 11,8 и 11,6 – с 6 недель до 6 месяцев после родов и 19,9 и 4,3 – с 6 до 12 месяцев после родов [44]. Возможно, причиной повышенного риска инсульта в послеродовом периоде служат изменения в системе гемостаза в сторону гиперкоагуляции, направленные на защиту от кровопотери в родах, а также резкое уменьшение объема циркулирующей крови, колебания гормональных уровней и изменения структуры стенки сосудов. Это данные указывают на необходимость длительного наблюдения, контроля состояния системы гемостаза и разработок методов реабилитации у данной группы пациенток.
Факторы риска инсульта у женщин детородного возраста
Факторы риска развития инсульта при беременности включают те же самые причины, что и у небеременных: артериальную гипертензию, атеросклероз, курение, заболевания клапанов сердца, протезированные клапаны сердца, фибрилляцию предсердий, мигрень, системную красную волчанку, системные васкулиты. Причиной ишемического инсульта могут стать тромбозы, эмболии, спазм сосудов головного мозга, гипоперфузия. Однако если у лиц пожилого возраста основной причиной инсульта служит атеротромбоз, который нередко возникает на фоне целого ряда длительно существующих хронических состояний, включая артериальную гипертензию, дислипидемию, сахарный диабет, ишемическую болезнь сердца, только у 15-25% беременных с фатальным инсультом были выявлены атеросклеротические поражения сосудов [49]. Более того, у женщин детородного возраста инсульт нередко развивается на фоне полного здоровья без предшествующих явных факторов риска [40]. В то же время ряд осложнений беременности (тяжелые формы гестоза, эмболия околоплодными водами, акушерские кровотечения, послеродовые септические осложнения) являются совершенно отдельными, специфическими провоцирующими факторами инсульта. Эти данные свидетельствуют о необходимости подробного изучения факторов риска инсульта у женщин детородного возраста и о том, что многие из них нам до сих пор остаются неизвестными.
Особую группу риска по развитию артериальных тромбоэмболий во время беременности составляют пациентки с заболеваниями клапанов сердца: выраженным, гемодинамически значимым пролапсом митрального клапана с высокой степенью регургитации, ревматическими пороками сердца, протезированными клапанами сердца. Например, при бактериальном эндокардите частота церебрального тромбоэмболизма достигает 20% [49]. Риск тромбоэмболий значительно повышается при нарушениях ритма сердца, наиболее частым из которых является фибрилляция предсердий. Так, риск развития артериальных тромбоэмболий при фибрилляции предсердий составляет 10-23%, а тромбоэмболий головного мозга – 5-10%.
Наличие открытого овального окна (ООО), которое с развитием методик ультразвуковой диагностики стало выявляться в общей популяции до 30% случаев, представляет собой хорошо установленный фактор риска криптогенного инсульта у лиц молодого возраста и обнаруживается у таких пациентов примерно в 50% случаев. В условиях нарушений сердечного ритма риск кардиоэмболического инсульта при ООО возрастает еще в большей степени [40]. С учетом характерной для нормального гестационного процесса гиперкоагуляции и возможных изменений гемодинамики в родах, которые могут приводить к инверсии градиента давления и облегчению шунтирования по направлению справа налево, риск кардиоэмболии у беременных с ООО может быть еще выше, особенно при наличии тромбофилии. В редких случаях парадоксальная эмболия может быть обусловлена эмболией околоплодными водами.
Отмечено увеличение риска развития инсульта у многорожавших женщин, при кесаревом сечении по сравнению с самостоятельными родами, кроме того, риск инсульта значительно повышается с возрастом беременной (от 30 случаев на 100 тыс. при возрасте менее 20 лет до 90,5 на 100 тыс. – при возрасте старше 40 лет). Кесарево сечение, по данным разных авторов, ассоциируется с увеличением риска инсульта в 3-12 раз [22,14], что нельзя не учитывать в связи с продолжающейся тенденцией к расширению показаний к кесареву сечению и появлением такого понятия, как «кесарево сечение по желанию».
Риск как ишемического, так и геморрагического инсульта повышается у пациенток с тяжелыми формами гестоза. У 25-45% пациенток с инсультом, связанным с беременностью, имела место преэклапсия или эклампсия [45]. Более того, у женщин, беременность которых протекала на фоне гестоза, на 60% выше риск развития ишемического инсульта, не связанного с беременностью, а семейный анамнез сердечно-сосудистых заболеваний и, в частности инсульта, является фактором риска развития гестоза [32]. Интересно, что метаболический синдром является фоновым процессом для развития и сердечно-сосудистых осложнений и типичного осложнения беременности – гестоза. Более того, у женщин с метаболическим синдромом, преэклампсией и плацентарной недостаточностью в анамнезе, включая синдром задержки роста плода, в последующей жизни наблюдается повышение риска сердечно-сосудистых осложнений и более раннее их развития [35]. Все это свидетельствует об исходно существующем генетическом или приобретенном факторе, предрасполагающем как к развитию акушерских, так и сердечно-сосудистых осложнений, в качестве которых может выступать тромбофилия.
Новые данные о патогенезе ишемического инсульта
Патогенез развития инсульта в условиях гестоза до сих пор остается неизвестным. Предполагается ряд механизмов, включая формирование эндотелиальной дисфункции, что роднит гестозы с атеросклерозом, нарушение ауторегуляции сосудов головного мозга и повышение перфузионного давления, что приводит к баротравме и повреждению сосудов, а также гемоконцентрацию, активацию коагуляционного каскада и воспалительного ответа с развитием ДВС-синдрома и формированием микротромбоза и полиорганной недостаточности [36]. Следует отметить, что тромбоцитопения, которая указывается исследователями как фактор риска инсульта при беременности, может быть проявлением АФС, HELLP-синдрома, ДВС-синдрома, при этом наблюдается активация тромбоцитов, развитие состояния гиперагрегации, потребления тромбоцитов и формирование протромботического потенциала [22].
В последнее время отмечается все больший интерес к вопросу взаимосвязи между гормональной терапией и риском инсульта, в частности при применении гормональной контрацепции, заместительной гормональной терапии (ЗГТ), вспомогательных репродуктивных технологий. Риск инсульта при применении ОК повышается в среднем в 3 раза [29]. Ряд авторов сообщают о взаимосвязи между мутацией протромбина G20210A и мутацией FV Leiden и ишемическим инсультом у лиц молодого возраста. Pezzini A. и соавт. (2007) в исследовании с участием 108 женщин с ишемическим инсультом на фоне применения ОК показали, что риск инсульта при применении ОК и отсутствии тромбофилии повышается в 2,65 раз (95% ДИ 1,46-4,81), а при наличии минимум одного из изученных тромбофилических факторов (FV Leiden, мутация протромбина G20210A, MTHFR С677Т) – почти в 23 раза, что гораздо выше, чем результат, предполагаемый при суммировании отдельных значений рисков инсульта, связанных с приемом ОК или тромбофилией, при этом, с учетом верхней границы доверительного интервала 95%, относительный риск у таких женщин может возрастать в 116 раз [34].
Интересные данные были получены при анализе исходов более одного миллиона родов в Швеции. Факторами риска венозных тромбоэмболий и инсульта в этой популяции были преэклампсия, конец третьего триместра беременности, роды и послеродовый период, кесарево сечение, большое количество родов в анамнезе. При этом риск сосудистых осложнений возрастал в 3-12 раз [37]. Однако статистический анализ показал, что эти хорошо известные факторы риска не могут полностью объяснить повышение риска сосудистых осложнений во время беременности, что требует поиска других скрытых причин гестационных венозных и артериальных тромбозов.
Cо времени открытия Рудольфом Вирховым в 1884 г. трех главных факторов развития тромбов (замедление скорости кровотока, повреждение стенки сосуда, изменение свойств крови) был выявлен и изучен целый ряд механизмов, предрасполагающих к тромбозу, однако даже при тщательном анализе всех факторов риска причина тромбозов в 50% случаев остается неизвестной (так называемые «идиопатические» тромбозы) [33]. Беременность сама по себе является состоянием, при котором риск развития венозных тромбозов увеличивается в 5-6 раз [41]. Фактически, для физиологической беременности характерны все признаки триады Вирхова. В течение беременности наблюдается прогрессивное увеличение содержания прокоагулянтных факторов, снижение активности антикоагулянтной системы за счет развития резистентности к активированному протеину С (АРС), торможение фибринолиза.
В последние годы все больше внимания уделяется изучению роли тромбофилитических состояний как для развития акушерских осложнений, так и тромбоэмболических осложнений. В общей популяции генетические формы тромбофилии (мутация FV Leiden, протромбина, дефицит протеинов С и S, антитромбина III) и антифосфолипидный синдром (АФС) (приобретенная тромбофилия) в среднем встречаются у 15-20% населения, а при венозных тромбозах, по данным литературы, частота тромбофилий достигает 50% [13]. При ряде тромбофилических состояний риск ВТЭ повышается более чем в 100 раз, особенно при наличии гомозиготных, мультигенных форм тромбофилии или комбинированных форм (генетические тромбофилии + АФС) [41].
Резистентность к активированному протеину С встречается в среднем у 3-7% среди европейской популяции и у 20-30% пациентов с тромбозами [39]. Классическим примером резистентности к АРС является мутация FV Leiden, при которой фактор V и VIII становятся нечувствительными к инактивирующему влиянию протеина С, что приводит к избыточному формированию тромбина и торможению фибринолиза. Резистентность к АPC также может иметь место и при других мутациях фактора V (FV Hong-Kong, FV Cambridge, HRII-гаплотип), а также при целом ряде приобретенных факторов, включая циркуляцию АФА, прием оральных контрацептивов, инфекции, акушерские осложнения, протекающие на фоне хронического ДВС-синдрома, прежде всего в условиях гестоза.
Мутация протромбина G20210A ассоциируется с повышением уровня протромбина (активность фактора II достигает 130% и выше) и выявляется у 2-5% здорового населения. При этой мутации риск ВТЭ повышается в среднем в 3 раза [23]. Мутация протромбина G20210A была выявлена у 17% беременных с ВТЭ.
Исследования последних лет свидетельствуют о четкой связи генетических тромбофилий и АФС с такими осложнениями беременности, как синдром потери плода, фетоплацентарная недостаточность (ФПН), синдром задержки роста плода (СЗРП), внутриутробная гибель плода, преждевременная отслойка нормально расположенной плаценты (ПОНРП), тяжелые формы гестоза [2,23,30]. Если ранее роль тромбофилии в патогенезе осложнений беременности рассматривалась только с точки зрения процессов микротромбирования сосудов плацентарного ложа, то в настоящее время взгляды на патогенетическое влияние тромбофилии значительно расширились. Это связано с изучением роли системы гемостаза и нетромботических эффектов тромбофилии еще на этапах имплантации плодного яйца и инвазии трофобласта.
АФС является одним из наиболее важных факторов риска тромбоэмболических осложнений во время беременности. На сегодняшний день под АФС понимают симптомокомплекс, сочетающий клинические признаки и лабораторные данные – наличие антифосфолипидных антител в сочетании с артериальными и/или венозными тромбозами и/или акушерскими осложнениями [2,23,30] (см. рис. 1). Во время беременности тромбозы манифестируют у 30% пациенток с АФС. Риск рецидива ВТЭ при АФС значительно выше, чем в общей популяции, и достигает 70%.
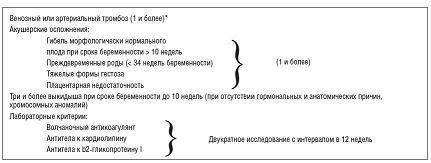 | Рисунок 1: Рисунок 1. Современные критерии антифосфолипидного синдрома.
*Для установления диагноза АФС достаточно одного лабораторного и одного клинического критерия. |
Патогенетическими механизмами развития тромбозов при АФС являются: взаимодействие с фосфолипидами эндотелиальных клеток и тромбоцитов, нарушение секреции простациклина, нарушение контактной активации фибринолиза, ингибиция тканевого активатора плазминогена (t-PA), тромбомодулина/протеина С/протеина S, индукция резистентности к APC.
Гипергомоцистеинемию связывают с ранним развитием атеросклероза и повышением риска тромбозов. Наиболее часто причиной гипергомоцистеинемии является мутация метилентетрагидрафолатредуктазы MTHFR С677T, частота которой в общей популяции составляет 10-20% [21]. Однако данные литературы относительно роли мутации MTHFR C677T как фактора повышенного риска ВТЭ и акушерских осложнений противоречивы [1,17]. Гипергомоцистеинемия является единственной наследственной аномалией гемостаза, которая сравнительно легко компенсируется при применении фолиевой кислоты и витаминов группы В. Для нашей страны характерно отсутствие концепции «здорового образа жизни» и дефицит в пищевом рационе необходимых витаминов и антиоксидантов. Поэтому дальнейшее изучение роли гипергомоцистеинемии для развития артериальных тромбозов во время беременности представляется весьма важным.
В ряде исследований была изучена взаимосвязь между мутацией FV Leiden, мутацией протромбина G20210A, дефектов антикоагулянтной системы, в частности дефицита антитромбина III, протеина C и протеина S, и артериальными тромбозами. Результаты этих исследований довольно противоречивы и в целом свидетельствуют об отсутствии взаимосвязи между данными формами тромбофилии и инфарктом миокарда или ишемическим инсультом в общей популяции [4]. Тем не менее, предположения о том, что тромбофилические состояния, в т.ч. мутация FV Leiden и мутация протромбина G202010А, более часто встречаются у пациентов с идиопатическим инсультом и инфарктом миокарда в молодом возрасте, не страдающих атеросклерозом, нашли подтверждение в мировой литературе [19].
Доказано, что гипергомоцистеинемия и мутация MTHFR C677T являются независимыми факторами риска артериальных тромбозов, в т.ч. и ишемического инсульта, и мощным прогностическим фактором летального исхода [19]. Выявлена ассоциация между повышением уровня гомоцистеина в крови и риском инфаркта миокарда у молодых женщин. Voetsch B. и соавт. (2000) выявили взаимосвязь между мутацией MTHFR C677T и ишемическим инсультом в отдельных этнических группах, поэтому большое значение при оценке взаимосвязи между генетической предрасположенностью к гипергомоцистеинемии и риском артериальных тромбозов имеет учет национальных особенностей питания и распространенности генетических дефектов компонентов фолатного цикла в разных популяциях [47].
Связь с артериальными тромбозами также была выявлена и для некоторых дефектов фибринолиза, хотя информация по этому вопросу крайне ограничена, а данная тема остается предметом продолжающихся исследований и дискуссий.
Важное значение у пациентов с тромбофилиями может иметь воздействие дополнительных факторов риска. Так, у курящих пациентов при наличии мутации FV Leiden риски инфаркта миокарда и ишемического инсульта увеличиваются с пограничных значений до 8-32 раз [27]. Martinelli I. и соавт. (2006) установили повышение риска ишемического инсульта в два раза в течение первых 6-18 месяцев использования ОК и в 3,5 раз – при наличии гипергомоцистеинемии, а при одновременном использовании ОК и наличии мутации FV Leiden или гипергомоцистеинемии риск инсульта возрастал соответственно в 13 и в 9 раз [29].
Тестирования на тромбофилии необходимы у пациентов из младшей возрастной группы с ишемическим инсультом, что может повлиять на тактику дальнейшего ведения и разработку профилактики повторных артериальных и венозных тромботических осложнений [19]. Кроме того, имеются предположения о том, что тромбофилия может влиять на тяжесть ишемических поражений, приводя к более обширному тромбозу в острую фазу, и обуславливать повышенный риск рецидивов [19]. Более того, некоторые авторы указывают на то, что от типа тромбофилии может зависеть характер проявлений инсульта. Szolnoki Z. (2001) обнаружили, что полиморфизм гена АПФ I/D ассоциируется с мелкососудистыми инфарктами, тогда как мутация FV Leiden может предрасполагать к крупноочаговым поражениям головного мозга [43].
Рядом ученых изучалась взаимосвязь между тромбофилией и инсультами, связанными с беременностью. Witlin A.G. и соавт. (2000), обобщив 20-летний опыт работы, описали 20 случаев инсультов, связанных с беременностью, причем одним из факторов риска у этих пациентов выступала генетическая тромбофилия, преимущественно связанная с дефектами антикоагулянтной системы: дефицитом протеина С, протеина S или антитромбина III [50]. Kupferminc M.J. и соавт. (2000) среди 12 пациенток с первым эпизодом ишемии головного мозга во время беременности обнаружили тромбофилию у 83% по сравнению с 17% в контрольной группе. В спектр изученных тромбофилий входили: мутация FV Leiden, мутация протромбина MTHRF С677Е, дефицит антитромбина III, протеина С, протеина S. Авторы сделали вывод о необходимости исследования на генетические формы тромбофилии у пациенток с нарушениями мозгового кровообращения по ишемическому типу во время беременности [26].
Более однозначные данные накоплены в отношении взаимосвязи между риском артериальных тромбозов, в т.ч. рецидивирующих, и АФС [5], в частности, между АФС и ишемическим инсультом у молодых женщин. По аналогии с генетическими формами тромбофилии АФА чаще обнаруживаются у пациентов более молодого возраста, при рецидивирующих тромбозах, у пациентов, у которых не выявляются широко известные факторы риска, например, атеросклероз. Инсульт в среднем развивается на 10 лет раньше у пациентов с циркуляцией АФА по сравнению с общей популяцией. АФА были обнаружены у 65% пациентов с инсультом в возрасте до 60 лет и у 28% с ТИА [5]. Циркуляция АФА была выявлена у 20% пациентов с инфарктом миокарда младше 45 лет, причем у 60% из них впоследствии развились повторные тромбозы. Среди многообразия подкслассов АФА особенно неблагоприятное влияние, по всей видимости, оказывают анти-β2-гликопротеин и феномен ВА, в то время как аКЛ и антитела к протромбину могут не играть роли для развития ишемических инсультов [46]. Так, в исследовании Urbanus R.T. и соавт. (2010), в которое было включено 175 женщин с ишемическим инсультом и 203 пациентки с инфарктом миокарда в анамнезе, отношения шансов для развития инфаркта миокарда при феномене ВА составили 5,3 (95% ДИ 1,4-20,8) и значительно повышались при применении ОК до 21,6 (1,9-242,0) и у курящих лиц (33,7 (6,0-189,0)), Для ишемического инсульта аналогичные показатели у пациентов с ВА составили 43,1 (12,2-152,0), 201,0 (22,1-1828,0) и 87,0 (14,5-523,0). У женщин с анти-бета2-гликопротеином риск ишемического инсульта был повышен в 2,3 раза (1,4-3,7), однако для инфаркта миокарда статистически значимые результаты получены не были [46]. Тем не менее, Cojocaru IM и соавт. (2007) установили взаимосвязь между повышенным титром антител IgG к кардиолипинам и ишемическим инсультом у молодых женщин [10]. Поэтому для исключения АФС у пациентов с ишемическим инсультом может быть рекомендовано обязательное тестирование на все кофакторы антифосфолипидных антител [5].
Таким образом, роль тромбофилий в патогенезе гестационных тромбозов и значение выявленных аномалий системы гемостаза для выработки плана ведения пациенток и профилактики рецидива тромбозов требует дальнейшего изучения.
Отдаленные последствия и тактика дальнейшего ведения пациенток детородного возраста, перенесших ишемический инсульт
Что касается артериальных тромбозов, ишемический инсульт редко служит причиной материнской смертности, которая в основном обусловлена вторичным кровоизлиянием и злокачественной гипертензией [44]. В целом летальность, связанная с ОНМК во время беременности (4,1%), ниже, чем в общей популяции в целом (24%) и у лиц с инсультом в молодом возрасте (4,5-24%) [22]. У молодых пациенток, перенесших инсульт во время беременности, больше резервных возможностей для восстановления неврологических функций. Нередко такие женщины планируют новую беременность, что ставит перед специалистами вопрос о дальнейшем ведении таких больных и о профилактике повторного инсульта во время беременности. Однако исследований, изучающих риск рецидивов инсультов во время беременности, исходы беременности у женщин с ОНМК в анамнезе, тактику профилактической терапии и ориентированных на разработку рекомендаций для таких пациенток, на удивление очень мало [12,28].
По одним данным вероятность рецидива инсульта при повторной беременности очень маленькая и составляет лишь около 1% [12,28]. С. Lamy и соавт. (2000) при наблюдении 187 беременностей у 125 пациенток, перенесших ишемический инсульт, зарегистрировали 13 рецидивов, из которых только два были связаны с беременностью. Исходы беременностей были сходными с ожидаемыми для общей популяции [28]. В связи с низкой частотой повторных случаев ОНМК авторы делают вывод о том, что инсульт не является противопоказанием для беременности в будущем. Риск рецидива инсульта составил соответственно 0,5% у пациенток, которые в последующем не беременели, 1,8% – у женщин, которые вынашивали беременности, и различался в среднем на 1,3%. Однако для этого показателя был выявлен широкий доверительный интервал 95%, в связи с чем истинное повышение риска может достигать 7,5%. В этом исследовании также сообщается об отсутствии рецидивов инсультов у пяти пациенток с тромбофилией в течение восьми беременностей, во время которых женщины получали антикоагулянтную терапию (нефракционированный гепарин [НФГ] или эноксапарин). Совсем другие данные были получены Soriano D. и соавт. (2002), которые отследили исходы 15 беременностей у 12 пациенток с ОНМК в анамнезе и тромбофилией (АФС, дефицитом протеина С, протеина S, антитромбина III, мутацией MTHFR С677Т). Несмотря на терапию низкомолекулярным гепарином (НМГ) и аспирином во время беременности, было отмечено четыре случая рецидива тромбозов (27%) и высокая частота акушерских и перинатальных осложнений. Важно отметить, что риск рецидива инсульта в послеродовом периоде по сравнению с самой беременностью повышается в 2-3 раза [9,28].
Прежде чем обсуждать возможность применения различных антитромботических препаратов во время беременности, необходимо рассмотреть вопрос об их безопасности для матери и для плода. Сразу следует оговориться, что применение антагонистов витамина К во время беременности допустимо только у женщин с крайне высоким риском тромбозов, а именно при наличии искусственных клапанов сердца. Во всех остальных случаях требуется обязательный перевод на НМГ или НФГ. Это требование обусловлено тем, что антагонисты витамина К проникают через плаценту и потенциально могут вызывать задержку роста плода, кровотечения у плода и тератогенные эффекты [8].
Возможность применения аспирина изучали для профилактики различных осложнений беременности, включая профилактику гестозов у пациенток из группы риска, у женщин с синдромом потери плода и АФС, для улучшения результатов экстракорпорального оплодотворения. Безопасность применения аспирина в I триместре беременности до конца не ясна, однако четкие доказательства неблагоприятного влияния на плод отсутствуют. Несмотря на то, что в ранних ретроспективных исследованиях были выявлены тератогенные эффекты при применении аспирина в I триместре беременности, в последующих проспективных исследованиях эти результаты не нашли подтверждений. В метаанализе 14 рандомизированных исследований с участием 12416 женщин, которые получали низкие дозы аспирина (50-150 мг/сут.) в течение II и III триместра беременности для профилактики преэклампсии, терапия показала себя безопасной как для матери, так и для плода [11]. Потенциальный риск назначения аспирина в III триместре беременности обуславливает увеличение риска геморрагических осложнений у матери и плода, преждевременное закрытие артериального протока, а также (теоретически) увеличение продолжительности родов и тенденцию к перенашиванию беременности. Однако следует отметить, что назначения только одного аспирина для профилактики тромбоэмболических осложнений недостаточно, в т.ч. и у пациенток с АФС [22].
Дипиридамол (Курантил) является дериватом пиримидопиримидина и обладает сосудорасширяющими свойствами. Обнаружено, что он угнетает агрегацию тромбоцитов в цельной крови в более низких концентрациях, чем в плазме, однако механизмы антитромбоцитарного эффекта все еще остаются спорными.
В качестве возможных антитромбоцитарных механизмов в настоящее время рассматриваются:
а) угнетение тромбоцитарной фосфодиэстеразы – фермента, расщепляющего цАМФ до 5-АМФ, в результате чего происходит накопление цАМФ в тромбоцитах;
б) блокада аденозина на уровне А2-аденозиновых рецепторов тромбоцитов, что стимулирует тромбоцитарную аденилатциклазу.
Среди возможных антитромбоцитарных механизмов внимания заслуживают и другие концепции. Так, существуют данные о прямой стимуляции синтеза простациклина. Однако необходимые для этого концентрации значительно превышают нижний микромолекулярный уровень в плазме, который достигается после перорального приема обычной дозы (100-400 мг/день). Кроме того, дипиридамол ингибирует активность ренина в плазме крови и снижает концентрацию альдостерона, тем самым подавляя активность ренинангиотензинальдостероновой системы, что может оказывать положительную роль у пациентов с артериальной гипертензией и гестозами.
Недавно был показан еще один механизм действия дипиридамола. В терапевтических концентрациях этот препарат способствует подавлению экспрессии и высвобождению матриксной металлопротеиназы 9 (MMP-9) за счет ингибирования активации и ядерной транслокации TNF-альфаиндуцируемого ядерного фактора (NF)-kB. В настоящее время ММР-9 отводят важную роль в патогенезе инсульта в связи с ее способностью стимулировать деградацию экстрацеллюлярного матрикса, что приводит к нарушению гематоэнцефалического барьера и увеличению площади ишемии. Таким образом, дипиридамол обладает противовоспалительными свойствами, что может обуславливать положительные эффекты этого препарата на микроциркуляцию, независимые от антитромбоцитарной активности. Такая антиоксидантная и противовоспалительная активность дипиридамола может оказывать существенную пложительную роль для профилактики эндотелиальной дисфункции, в частности у пациенток с гипергомоцистеинемией, для которых характерно состояние персистирующего оксидативного стресса, нарушений микроциркуляции и гиперагрегации тромбоцитов.
В настоящее время большинство исследователей склоняются к мысли, что дипиридамол не обладает достаточным антитромбоцитарным и противотромботическим эффектом, если применяется в качестве монотерапии, в то же время комбинация с аспирином весьма эффективна. В своей практике мы применяем дипиридамол в высоких и средних дозах при недостаточной эффективности аспирина под контролем агрегации тромбоцитов.
Таким образом, дипиридамол обладает ангиопротекторной активностью, антиоксидантными свойствами, улучшает микроциркуляцию путем снижения тонуса артериол, уменьшения адгезии и агрегации тромбоцитов, снижения деформируемости эритроцитов, способствует формированию коллатералей, препятствует развитию эндотелиальной дисфункции.
НФГ и НМГ не проникают через плаценту и, в связи с этим, не обладают тератогенными эффектами и не связаны с риском геморрагических осложнений у плода. Небольшие количества НМГ, выявляемые в грудном молоке, по всей видимости, не имеют клинического значения в связи с крайне низкой доступностью при пероральном применении. Осложнения, которые могут возникнуть у беременной на фоне применения антитромботической терапии, аналогичны тем, которые регистрируются в общей популяции и включают кровотечения (риск, связанный с применением любых антитромботических препаратов), а также гепарининдуцированную тромбоцитопению (ГИТ), остеопороз и локальные реакции в местах инъекций для НФГ и НМГ. Риск всех описанных осложнений при применении НМГ значительно ниже, чем при использовании НФГ. Частота тяжелых кровотечений при применении НФГ во время беременности составляет около 2%. Приблизительно у 3% небеременных, получающих НФГ, развивается ГИТ, которая может привести к прогрессированию имеющегося тромбоза и к возникновению новых артериальных и венозных тромбоэмболий [48]. По результатам применения НМГ у 486 беременных частота легких кровотечений составила 2,7%, а тяжелых кровотечений зарегистрировано не было [38]. По данным систематического обзора, который включал 64 исследования с участием 2777 беременных, частота тяжелых кровотечений при применении НМГ составила 0,43% (95% ДИ 0,22-0,75%) в течение беременности и 0,95% (0,61-1,37%) – в послеродовом периоде, частота раневых гематом – 0,61 (0,36-0,98), а общая частота кровотечений – 1,98 (1,5-2,57) [18]. Применение НМГ во время беременности связано с меньшим риском развития ГИТ по сравнению с назначением НФГ и даже, возможно, ниже, чем в общей популяции [38,18]. Более того, несколько исследований свидетельствуют о том, что профилактическое назначение НМГ во время беременности сопровождается такой же потерей костной массы, которая характерна и для физиологической беременности [7].
Учитывая безопасность как для матери, так и для плода, лучшую биодоступность, более длительное время полужизни в плазме крови, более предсказуемый ответ на лечение и большую безопасность в отношении развития остеопороза и ГИТ, а также удобство в применении для лечения и профилактики ВТЭ во время беременности следует отдавать НМГ.
Учитывая данные о взаимосвязи между тромбофилией и неблагоприятными исходами беременности, все больший интерес появляется к применению антитромботической терапии для профилактики не только тромбозов и тромбоэмболий, но и осложнений беременности.
По данным крупных систематических обзоров, назначение низких доз аспирина сопровождается умеренным снижением риска преэклампсии (примерно на 15-20%) и других неблагоприятных исходов беременности, включая фетальную и неонатальную смертность, причем у женщин из группы высокого риска положительный эффект антитромботической терапии более заметен [11]. В последующем было выдвинуто предположение о том, что у женщин с высоким риском тяжелых гестозов может быть эффективно профилактическое применение препаратов гепарина. Эта гипотеза является патогенетически обоснованной, учитывая наличие у НМГ не только противотромботических эффектов, но и противовоспалительной активности и его способность влиять на формирование плаценты. Так, для НМГ был выявлен антиапоптотический эффект в отношении трофобласта [20]. В рандомизированном исследовании с участием 80 пациенток с преэклампсией в анамнезе и полиморфизмом гена АПФ I/D профилактическое назначение НМГ (далтепарин 5000 ед./сут.) сопровождалось снижением риска преэклампсии, СЗРП, улучшением показателей маточноплацентарного кровотока [31].
Комбинированная терапия гепарином и аспирином в низких дозах неоднократно доказала свою эффективность в различных подгруппах пациенток с высоким риском тромботических и акушерских осложнений, включая женщин с венозными тромбоэмболиями в анамнезе, пациенток с АФС и синдромом потери плода [3]. По данным последнего систематического обзора, в который было включено 12 исследований с участием всего 849 пациенток с АФС и синдромом потери плода в анамнезе, среди всех возможных вмешательств только НФГ в сочетании с низкими дозами аспирина достоверно снижал риск повторных потерь плода [16]. При этом повышение дозы НФГ и аспирина не сопровождалось улучшением эффекта, а монотерапия аспирином и вовсе не показала свою эффективность. Недавние исследования также показали, что НМГ в комбинации с аспирином эквивалентен по своей эффективности комбинации НФГ плюс аспирин.
Вопрос о ведении беременности у женщин с инсультом в анамнезе и о возможностях профилактики повторных тромботических осложнений также остается открытым. Единый протокол для таких пациенток, по данным мировой литературы, выработан не был. По мнению ряда авторов, у пациенток, перенесших ишемический инсульт, рекомендовано применение низких доз аспирина во время беременности в послеродовом периоде [9,18,40,42]. Soriano D. и соавт. (2002) предлагают применять у женщин с ОНМК в анамнезе низкие дозы аспирина в комбинации с профилактическими дозами нефракционированного гепарина или НМГ и проводить у них тщательный контроль в связи с высоким риском как акушерских осложнений, так и осложнений со стороны плода [42].
Значение выявления генетической и приобретенной тромбофилии при ведении беременности у пациенток с ишемическим инсультом в анамнезе
На базе специализированного родильного дома № 67 было обследовано 59 пациенток с инсультами (средний возраст 32±5,5 лет). У 22 из них инсульт возник во время данной беременности или в раннем послеродовом периоде. У 20 пациенток с ишемическим инсультом в анамнезе (подгруппа 1) проводилось планирование настоящей беременности и специфическая профилактика (низкомолекулярный гепарин [НМГ] в течение всей беременности в послеродовом периоде, витамины группы В, фолиевая кислота до 4 мг/сут., антиоксиданты, аспирин по показаниям), а у 17 пациенток (подгруппа 2) терапия была начата во II-III триместре беременности в момент обращения. У всех пациенток было проведено исследование системы гемостаза, скрининг на генетические формы тромбофилии, полиморфизмы провоспалительных цитокинов и антифосфолипидные антитела (АФА).
Результаты исследования
Основными провоцирующими факторами тромбозов было наличие системных заболеваний (системная красная волчанка, системные васкулиты и др.) (16,9%), прием оральных контрацептивов (3,4%), оперативные вмешательства и/или травмы (1,7%), септические осложнения (6,8%), ранее перенесенные тромботические осложнения (27,1%), метаболический синдром (37,3%), гипертоническая болезнь (27,1%), нарушения сердечного ритма (5,1%), наличие искусственных клапанов сердца (6,8%), неадекватная антикоагулянтная терапия у пациенток с механическими клапанами сердца (3,4%) и наличие открытого овального окна (5,1%). У повторнородящих (52,5%) была выявлена достоверно более высокая частота акушерских осложнений в анамнезе по сравнению с контрольной группой (69,4% соответственно против 18,3%; отношение шансов ОШ 9,6, 95% доверительный интервал ДИ 4,1-22,8, p<0,001), в частности, синдрома потери плода 33,3% против 0%; p<0,001) и акушерских осложнений сосудистого генеза (гестозы, преждевременная отслойка нормально расположенной плаценты, фетоплацентарная недостаточность, СЗРП, антенатальная гибель плода) (38,7% против 11,5%; ОШ 10,1, 95% ДИ 3,8-26,5, p<0,05).
При исследовании системы гемостаза у всех пациенток были выявлены маркеры ее активации: повышение уровня РКФМ, D-димера (в среднем 2-3 мкг/мл при норме до 0,5). В совокупности данные о крайне отягощенном соматическом, акушерском и семейном анамнезе, о развитии столь тяжелых тромбоэмболических осложнений у женщин молодого возраста позволили нам предположить наличие генетической предрасположенности к тромбозам. Данные генетических исследований были получены у 51 пациентки. У 88,2% (р<0,001 по сравнению с 26,7% в контрольной группе; ОШ 20,6, 5% ДИ 7,4-57,5) были выявлены генетические формы тромбофилии, среди которых превалировали гетерозиготная мутация FV Leiden (21,6%), гетерозиготная мутация протромбина G20210A (11,7%), гомозиготная (29,4%) и гетерозиготная (33,3%) мутации MTHFR С677Т, комбинированные дефекты фибринолиза (полиморфизмы генов PAI-1 4G/5G, t-PA I/D, фибриногена -455 G/А, фактора Хагемана 46 С/Т) (76,5%), полиморфизмы генов рецепторов тромбоцитов, генов, регулирующих ренинангиотензинальдостероновую систему, а также АФА (41,2%). В 1-й подгруппе пациенток, у которых патогенетическая терапия была начата на этапе планирования беременности, беременность закончилась рождением живого, доношенного ребенка в 100% случаев при отсутствии тяжелых акушерских осложнений. Во 2-й подгруппе было отмечено развитие тяжелых и среднетяжелых акушерских осложнений (тяжелые формы гестоза, СЗРП I-III, критические нарушения маточноплацентарного кровотока), подострого ДВС-синдрома; у пациенток часто возникала необходимость в досрочном родоразрешении (23,5%) и наблюдалось рождение недоношенных, гипотрофичных детей с низкой оценкой по шкале Апгар (р<0,05 для всех сравнений между подгруппой 1 и 2). На фоне терапии НМГ развития повторных тромботических и геморрагических осложнений отмечено не было.
Заключение
Пациентки с ОНМК в анамнезе представляют группу крайне высокого риска по развитию тяжелых акушерских и повторных тромботических осложнений, особенно в условиях характерной для беременности активации системы гемостаза. Выявление мульгенных форм тромбофилии и АФА у большинства пациенток с ОНМК позволяет говорить о патологии гемостаза как о ведущей причине возникновения этого осложнения. Таким образом, ведущую роль в патогенезе криптогенного ишемического инсульта у женщин детородного возраста, по всей видимости, играют фоновые нарушения гемостаза как наследственные, так и приобретенные. При планировании беременности у пациенток с ишемическим инсультом в анамнезе необходимо детальное обследование, включающее оценку состояния сердечно-сосудистой системы, исключение структурных аномалий сердца, нарушений сердечного ритма, а также комплексное исследование системы гемостаза с целью выявления генетических и/или приобретенных тромбофиий (АФС, гипергомоцистеинемия). Результаты такого обследования позволят оценить риск повторных инсультов, венозных тромбозов и акушерских осложнений и спланировать патогенетически обоснованную тактику ведения беременности. Тактика ведения беременности у женщин с ОНМК в анамнезе включает в себя обязательное применение НМГ в течение всей беременности (желательно еще до ее наступления), антиоксидантов, витаминов группы В, высоких доз фолиевой кислоты, антиагрегантов. Терапия НМГ проводится под контролем D-димера. ОНМК в анамнезе является абсолютным показанием к кесареву сечению. НМГ отменяют за сутки до операции и возобновляют через 6-8 часов. Разработанная нами тактика ведения беременности с применением НМГ под контролем системы гемостаза у пациенток с инсультом в анамнезе позволила в 100% случаях добиться рождения живых детей и избежать развития тяжелых акушерских и повторных тромботических осложнений.
Литература:
1. Макацария А.Д., Белобородова Е.В., Баймурадова С.М., Бицадзе В.О. Гипергомоцистеинемия и осложнения беременности. М. 2005; 216 с.
2. Макацария А.Д., Бицадзе В.О., Баймурадова С.М., Долгушина Н.В., Юдаева Л.С., Хизроева Д.Х., Акиньшина С.В. Антифосфолипидный синдром – иммунная тромбофилии в акушерстве и гинекологии. М. 2007; 456 с.
3. Bates S.M., Greer I.A., Pabinger I. et al.; American College of Chest Physicians. Venous thromboembolism, thrombophilia, antithrombotic therapy, and pregnancy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008 Jun; 133 (6): 844-886.
4. Boekholdt S.M., Kramer M.H. Arterial thrombosis and the role of thrombophilia. Semin. Thromb. Hemost. 2007 Sep; 33 (6): 588-96.
5. Brey R.L. Antiphospholipid antibodies in young adults with stroke. J. Thromb. Thrombolysis. 2005 Oct; 20 (2):105-12.
6. Carbillon L. Pregnancy is an essential spontaneous screening stress test for the risk of early stroke in women. Stroke. 2008 Aug; 39 (8): 138.
7. Carlin A.J., Farquharson R.G., Quenby S.M. et al. Prospective observational study of bone mineral density during pregnancy: low molecular weight heparin versus control. Hum Reprod. 2004 May; 19 (5): 1211-4.
8. Chan W.S. Venous thromboembolism in pregnancy. Expert Rev Cardiovasc Ther. 2010 Dec; 8 (12): 1731-40.
9. Clark P., Greer I.A. Prevention and treatment of arterial thrombosis in pregnancy. Semin Thromb Hemost. 2003 Apr; 29 (2): 155-64.
10. Cojocaru I.M., Cojocaru M., Burcin C., Atanasiu A. Evaluation of antiphospholipid antibodies in young women with ischemic stroke. Rom. J. Intern. Med. 2007; 45 (2): 201-4.
11. Coomarasamy A., Honest H., Papaioannou S. et al. Aspirin for prevention of preeclampsia in women with historical risk factors: a systematic review. Obstet. Gynecol. 2003 Jun; 101 (6): 1319-32.
12. Coppage K.H., Hinton A.C., Moldenhauer J. et al. Maternal and perinatal outcome in women with a history of stroke. Amer. J. Obstet. Gynecol. 2004; 190 (5): 1331-34.
13. Coppola A., Tufano A., Cerbone A.M., Di Minno G. Inherited thrombophilia: implications for prevention and treatment of venous thromboembolism. Semin Thromb Hemost. 2009 Oct; 35 (7): 683-94.
14. Davie C.A., OBrien P. Stroke and pregnancy. J. Neurol. Neurosurg. Psychiatry. 2008 Mar; 79 (3): 240-5.
15. Di Carlo A, Lamassa M, Baldereschi M et al; European BIOMED Study of Stroke Care Group. Sex differences in the clinical presentation, resource use, and 3-month outcome of acute stroke in Europe: data from a multicenter multinational hospital-based registry. Stroke. 2003 May; 34 (5): 1114-9.
16. Empson M., Lassere M., Craig J., Scott J. Prevention of recurrent miscarriage for women with antiphospholipid antibody or lupus anticoagulant. Cochrane Database Syst Rev. 2005 Apr 18; (2): CD002859.
17. Govindaiah V., Naushad S.M., Prabhakara K. et al. Association of parental hyperhomocysteinemia and C677T Methylene tetrahydrofolate reductase (MTHFR) polymorphism with recurrent pregnancy loss. Clin. Biochem. 2009 Mar; 42 (4-5): 380-6.
18. Greer I.A., Nelson-Piercy C. Low-molecular-weight heparins for thromboprophylaxis and treatment of venous thromboembolism in pregnancy: a systematic review of safety and efficacy. Blood. 2005 Jul 15; 106 (2): 401-7.
19. Haywood S., Liesner R., Pindora S., Ganesan V. Thrombophilia and first arterial ischaemic stroke: a systematic review. Arch Dis. Child. 2005 Apr; 90 (4): 402-5.
20. Hills F.A., Abrahams V.M., González-Timón B et al. Heparin prevents programmed cell death in human trophoblast. Mol Hum Reprod. 2006 Apr; 12 (4): 237-43.
21. Huang T., Yuan G., Zhang Z. et al. Cardiovascular pathogenesis in hyperhomocysteinemia. Asia Pac. J. Clin Nutr. 2008; 17 (1): 8-16.
22. James A.H., Bushnell C.D., Jamison M.G. et al. Incidence and risk factors for stroke in pregnancy and the puerperium. Obstet. Gynecol. 2005 Sep; 106 (3): 509-16.
23. Kitchens K.S., Alving B.M., Kessler C.M. Consultative haemostasis and thrombosis. Elsivier Science. 2002; 617 p.
24. Kittner S.J., Stern B.J., Feeser B.R. et al. Pregnancy and the risk of stroke. N. Engl. J. Med. 1996 Sep 12; 335 (11): 768-74.
25. Koniari I., Siminelakis S.N., Baikoussis N.G. et al. Antiphospholipid syndrome; its implication in cardiovascular diseases: a review. J. Cardiothorac. Surg. 2010 Nov 3; 5: 101.
26. Kupferminc M.J., Yair D., Bornstein N.M. et al. Transient focal neurological deficits during pregnancy in carriers of inherited thrombophilia. Stroke. 2000 Apr; 31 (4): 892-5.
27. Lalouschek W., Schillinger M., Hsieh K. et al. Matched case-control study on factor V Leiden and the prothrombin G20210A mutation in patients with ischemic stroke/transient ischemic attack up to the age of 60 years. Stroke. 2005 Jul; 36 (7): 1405-9.
28. Lamy C., Hamon J.B., Coste J., Mas J.L. Ischemic stroke in young women: risk of recurrence during subsequent pregnancies. French Study Group on Stroke in Pregnancy. Neurology. 2000; 55 (2): 269-74.
29. Martinelli I., Battaglioli T., Burgo I. et al. Oral contraceptive use, thrombophilia and their interaction in young women with ischemic stroke. Haematologica. 2006 Jun; 91 (6): 844-7.
30. Mehdi A.A., Uthman I., Khamashta M. Antiphospholipid syndrome: pathogenesis and a window of treatment opportunities in the future. Eur J. Clin Invest. 2010 May; 40 (5): 451-64.
31. Mello G., Parretti E., Fatini C. et al. Low-molecular-weight heparin lowers the recurrence rate of preeclampsia and restores the physiological vascular changes in angiotensin-converting enzyme DD women. Hypertension. 2005 Jan; 45 (1): 86-91.
32. Ness R.B., Markovic N., Bass D. et al. Family history of hypertension, heart disease, and stroke among women who develop hypertension in pregnancy. Obstet. Gynecol. 2003 Dec; 102 (6):1366-71.
33. Nicolaides A.N., Breddin H.K., Carpenter P. et al. European Genetics Foundation; Cardiovascular Disease Educational and Research Trust; International Union of Angiology; Mediterranean League on Thromboembolism. Thrombophilia and venous thromboembolism. International consensus statement. Guidelines according to scientific evidence. Int. Angiol. 2005 Mar; 24 (1): 1-26.
34. Pezzini A., Grassi M., Iacoviello L., Del Zotto E et al. Inherited thrombophilia and stratification of ischaemic stroke risk among users of oral contraceptives. J. Neurol. Neurosurg. Psychiatry. 2007 Mar; 78 (3): 271-6.
35. Ray J.G., Vermeulen M.J., Schull M.J., Redelmeier D.A. Cardiovascular health after maternal placental syndromes (CHAMPS): population-based retrospective cohort study. Lancet. 2005 Nov 19; 366 (9499): 1797-803.
36. Roberts J.M., Cooper D.W. Pathogenesis and genetics of pre-eclampsia. Lancet. 2001 Jan 6; 357 (9249): 53-6.
37. Ros H.S., Lichtenstein P., Bellocco R et al. Pulmonary embolism and stroke in relation to pregnancy: how can high-risk women be identified? Am. J. Obstet. Gynecol. 2002 Feb; 186 (2): 198-203.
38. Sanson B.J., Lensing A.W., Prins M.H. et al. Safety of low-molecular-weight heparin in pregnancy: a systematic review. Thromb. Haemost. 1999 May; 81 (5): 668-72.
39. Segers O., Castoldi E. Factor V Leiden and activated protein C resistance. Adv. Clin. Chem. 2009; 49: 121-57.
40. Sibai B.M., Coppage K.H. Diagnosis and management of women with stroke during pregnancy/postpartum. Clin. Perinatol. 2004 Dec; 31 (4): 853-68.
41. Simioni P., Tormene D, Spiezia L. et al. Inherited thrombophilia and venous thromboembolism. Semin Thromb Hemost. 2006 Oct; 32 (7): 700-8.
42. Soriano D., Carp H., Seidman D.S. et al. Management and outcome of pregnancy in women with thrombophylic disorders and past cerebrovascular events. Acta Obstet. Gynecol. Scand. 2002 Mar; 81 (3): 204-7.
43. Szolnoki Z., Somogyvбri F., Kondacs A. et al. Evaluation of the roles of the Leiden V mutation and ACE I/D polymorphism in subtypes of ischa--emic stroke. J. Neurol. 2001 Sep; 248 (9): 756-61.
44. Tang C.H., Wu C.S., Lee T.H. et al. Preeclampsia-eclampsia and the risk of stroke among peripartum in Taiwan. Stroke. 2009 Apr; 40 (4): 1162-8.
45. Treadwell S.D., Thanvi B., Robinson T.G. Stroke in pregnancy and the puerperium. Postgrad Med. J. 2008 May; 84 (991): 238-45.
46. Urbanus R.T., Siegerink B., Roest M. et al. Antiphospholipid antibodies and risk of myocardial infarction and ischaemic stroke in young women in the RATIO study: a case-control study. Lancet Neurol. 2009 Nov; 8 (11): 998-1005.
47. Voetsch B., Damasceno B.P., Camargo E.C. et al. Inherited thrombophilia as a risk factor for the development of ischemic stroke in young adults. Thromb Haemost. 2000 Feb; 83 (2): 229-33.
48. Warkentin T.E. Heparin-induced thrombocytopenia. Hematol. Oncol. Clin. North. Am. 2007 Aug; 21 (4): 589-607.
49. Wiebers D.O. Ischemic cerebrovascular complications of pregnancy. Arch. Neurol. 1985 Nov; 42 (11): 1106-13.
50. Witlin A.G., Mattar F., Sibai B.M. Postpartum stroke: a twenty-year experience. Am. J. Obs--tet. Gynecol. 2000 Jul; 183 (1): 83-8.
References:
1. Makacarija A.D., Beloborodova E.V., Bajmuradova S.M., Bicadze V.O. Gipergomocisteinemijaioslozhnenijaberemennosti. M. 2005; 216 s.
2. Makacarija A.D., Bicadze V.O., Bajmuradova S.M., Dolgushina N.V., Judaeva L.S., Hizroeva D.H., Akinshina S.V. Antifosfolipidnyjsindrom – immunnajatrombofilii v akusherstveiginekologii. M. 2007; 456 s.
3. Bates S.M., Greer I.A., Pabinger I. et al.; American College of Chest Physicians. Venous thromboembolism, thrombophilia, antithrombotic therapy, and pregnancy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008 Jun; 133 (6): 844-886.
4. Boekholdt S.M., Kramer M.H. Arterial thrombosis and the role of thrombophilia.Semin.Thromb.Hemost. 2007 Sep;33(6):588-96.
5. Brey R.L. Antiphospholipid antibodies in young adults with stroke. J.Thromb. Thrombolysis. 2005 Oct;20(2):105-12.
6. Carbillon L. Pregnancy is an essential spontaneous screening stress test for the risk of early stroke in women. Stroke. 2008 Aug;39(8):138.
7. Carlin A.J., Farquharson R.G., Quenby S.M.et al. Prospective observational study of bone mineral density during pregnancy: low molecular weight heparin versus control.Hum Reprod. 2004 May;19(5):1211-4.
8. Chan W.S. Venous thromboembolism in pregnancy. Expert Rev CardiovascTher. 2010 Dec;8(12):1731-40.
9. Clark P., Greer I.A. Prevention and treatment of arterial thrombosis in pregnancy.SeminThrombHemost. 2003 Apr;29(2):155-64.
10. Cojocaru I.M., Cojocaru M., Burcin C., Atanasiu A. Evaluation of antiphospholipid antibodies in young women with ischemic stroke. Rom. J. Intern. Med. 2007;45(2):201-4.
11. Coomarasamy A., Honest H., Papaioannou S. et al. Aspirin for prevention of preeclampsia in women with historical risk factors: a systematic review. Obstet. Gynecol. 2003 Jun;101(6):1319-32.
12. Coppage K.H., Hinton A.C., Moldenhauer J. et al. Maternal and perinatal outcome in women with a history of stroke. Amer. J. Obstet. Gynecol. 2004; 190 (5):1331-34.
13. Coppola A., Tufano A., Cerbone A.M., Di Minno G. Inherited thrombophilia: implications for prevention and treatment of venous thromboembolism.SeminThrombHemost. 2009 Oct;35(7):683-94.
14. Davie C.A., OBrien P. Stroke and pregnancy. J. Neurol.Neurosurg. Psychiatry. 2008 Mar;79(3):240-5.
15. Di Carlo A, Lamassa M, Baldereschi M et al; European BIOMED Study of Stroke Care Group. Sex differences in the clinical presentation, resource use, and 3-month outcome of acute stroke in Europe: data from a multicenter multinational hospital-based registry. Stroke. 2003 May;34(5):1114-9.
16. Empson M., Lassere M., Craig J., Scott J. Prevention of recurrent miscarriage for women with antiphospholipid antibody or lupus anticoagulant.Cochrane Database Syst Rev. 2005 Apr 18;(2):CD002859.
17. Govindaiah V., Naushad S.M., Prabhakara K. et al. Association of parental hyperhomocysteinemia and C677T Methylene tetrahydrofolate reductase (MTHFR) polymorphism with recurrent pregnancy loss.Clin.Biochem. 2009 Mar;42(4-5):380-6.
18. Greer I.A., Nelson-Piercy C. Low-molecular-weight heparins for thromboprophylaxis and treatment of venous thromboembolism in pregnancy: a systematic review of safety and efficacy. Blood. 2005 Jul 15;106(2):401-7.
19. Haywood S., Liesner R., Pindora S., Ganesan V. Thrombophilia and first arterial ischaemic stroke: a systematic review. Arch Dis. Child. 2005 Apr;90(4):402-5.
20. Hills F.A., Abrahams V.M., Gonzбlez-Timуn B et al. Heparin prevents programmed cell death in human trophoblast.Mol Hum Reprod.2006 Apr;12(4):237-43.
21. Huang T., Yuan G., Zhang Z. et al. Cardiovas-cular pathogenesis in hyperhomocysteinemia. Asia Pac. J.ClinNutr. 2008;17(1):8-16.
22. James A.H., Bushnell C.D., Jamison M.G. et al. Incidence and risk factors for stroke in pregnancy and the puerperium. Obstet. Gynecol. 2005 Sep; 106 (3): 509-16.
23. Kitchens K.S., Alving B.M., Kessler C.M. Consultative haemostasis and thrombosis. Elsivier Science. 2002; 617 p.
24. Kittner S.J., Stern B.J., Feeser B.R. et al. Pregnancy and the risk of stroke. N. Engl. J. Med. 1996 Sep 12;335(11):768-74.
25. Koniari I., Siminelakis S.N., Baikoussis N.G. et al. Antiphospholipid syndrome; its implication in cardiovascular diseases: a review. J.Cardiothorac. Surg. 2010 Nov 3;5:101.
26. Kupferminc M.J., Yair D., Bornstein N.M. et al. Transient focal neurological deficits during pregnancy in carriers of inherited thrombophilia. Stroke. 2000 Apr;31(4):892-5.
27. Lalouschek W., Schillinger M., Hsieh K.et al. Matched case-control study on factor V Leiden and the prothrombin G20210A mutation in patients with ischemic stroke/transient ischemic attack up to the age of 60 years.Stroke.2005 Jul;36(7):1405-9.
28. Lamy C., Hamon J.B., Coste J., Mas J.L. Ischemic stroke in young women: risk of recurrence during subsequent pregnancies. French Study Group on Stroke in Pregnancy. Neurology. 2000; 55 (2): 269-74.
29. Martinelli I., Battaglioli T., Burgo I. et al. Oral contraceptive use, thrombophilia and their interaction in young women with ischemic stroke.Haematologica. 2006 Jun;91(6):844-7.
30. Mehdi A.A., Uthman I., Khamashta M. Antiphospholipid syndrome: pathogenesis and a window of treatment opportunities in the future.Eur J.Clin Invest. 2010 May;40(5):451-64.
31. Mello G., Parretti E., Fatini C. et al. Low-molecular-weight heparin lowers the recurrence rate of preeclampsia and restores the physiological vascular changes in angiotensin-converting enzyme DD women. Hypertension. 2005 Jan;45(1):86-91.
32. Ness R.B., Markovic N., Bass D. et al. Family history of hypertension, heart disease, and stroke among women who develop hypertension in pregnancy. Obstet. Gynecol. 2003 Dec;102(6):1366-71.
33. Nicolaides A.N., Breddin H.K., Carpenter P. et al. European Genetics Foundation; Cardiovascular Disease Educational and Research Trust; International Union of Angiology; Mediterranean League on Thromboembolism. Thrombophilia and venous thromboembolism. International consensus statement. Guidelines according to scientific evidence. Int.Angiol. 2005 Mar;24(1):1-26.
34. Pezzini A., Grassi M., Iacoviello L., Del Zotto E et al. Inherited thrombophilia and stratification of ischaemic stroke risk among users of oral contraceptives. J. Neurol.Neurosurg. Psychiatry. 2007 Mar;78(3):271-6.
35. Ray J.G., Vermeulen M.J., Schull M.J., Redelmeier D.A. Cardiovascular health after maternal placental syndromes (CHAMPS): population-based retrospective cohort study. Lancet. 2005 Nov 19;366(9499):1797-803.
36. Roberts J.M., Cooper D.W. Pathogenesis and genetics of pre-eclampsia. Lancet. 2001 Jan 6;357(9249):53-6.
37. Ros H.S., Lichtenstein P., Bellocco R et al. Pulmonary embolism and stroke in relation to pregnancy: how can high-risk women be identified? Am. J. Obstet. Gynecol. 2002 Feb;186(2):198-203.
38. Sanson B.J., Lensing A.W., Prins M.H. et al. Safety of low-molecular-weight heparin in pregnancy: a systematic review.Thromb.Haemost. 1999 May;81(5):668-72.
39. Segers O., Castoldi E. Factor V Leiden and activated protein C resistance. Adv.Clin. Chem. 2009;49:121-57.
40. Sibai B.M., Coppage K.H. Diagnosis and management of women with stroke during pregnancy/postpartum.Clin.Perinatol. 2004 Dec;31(4):853-68.
41. Simioni P., Tormene D, Spiezia L. et al. Inherited thrombophilia and venous thromboembolism.SeminThrombHemost. 2006 Oct;32(7):700-8.
42. Soriano D., Carp H., Seidman D.S. et al. Management and outcome of pregnancy in women with thrombophylic disorders and past cerebrovascular events.Acta Obstet. Gynecol. Scand. 2002 Mar;81(3):204-7.
43. Szolnoki Z., Somogyvбri F., Kondacs A. et al. Evaluation of the roles of the Leiden V mutation and ACE I/D polymorphism in subtypes of ischaemic stroke. J. Neurol. 2001 Sep; 248(9): 756-61.
44. Tang C.H., Wu C.S., Lee T.H. et al. Preeclampsia-eclampsia and the risk of stroke among peripartum in Taiwan. Stroke. 2009 Apr;40(4):1162-8.
45. Treadwell S.D., Thanvi B., Robinson T.G. Stroke in pregnancy and the puerperium.Postgrad Med. J. 2008 May;84(991):238-45.
46. Urbanus R.T., Siegerink B., Roest M. et al. Antiphospholipid antibodies and risk of myocardial infarction and ischaemic stroke in young women in the RATIO study: a case-control study. Lancet Neurol. 2009 Nov;8(11):998-1005.
47. Voetsch B., Damasceno B.P., Camargo E.C.et al. Inherited thrombophilia as a risk factor for the development of ischemic stroke in young adults.ThrombHaemost. 2000 Feb;83(2):229-33.
48. Warkentin T.E. Heparin-induced thrombocytopenia.Hematol.Oncol.Clin. North. Am. 2007 Aug;21(4):589-607.
49. Wiebers D.O. Ischemic cerebrovascular complications of pregnancy. Arch. Neurol. 1985 Nov;42(11):1106-13.
50. Witlin A.G., Mattar F., Sibai B.M. Postpartum stroke: a twenty-year experience. Am. J. Obs--tet. Gynecol. 2000Jul;183(1):83-8.
Pregnancy in women with history of ischemic stroke and thrombophilia
Akinshina S.V., Makatsariya A.D., Bitsadze V.O.
State Federal-Funded Educational Institution of Higher Vocational Training I.M. Sechenov First Moscow State Medical University of the Ministry of Health of the Russian Federation
Abstract: currently due to reduction of direct causes of maternal mortality increasing interest of scientists cause arterial thrombotic complications. Pregnancy-related stroke is a rare event, however, when it occurs, may be life threatening and there may be implications for management of the patient and delivery. The mechanisms and risk factors for ischemic stroke related to pregnancy and in women of childbearing age remain unclear. Pathogenesis of so severe complication in young women is not fully understood, however, there is a concept thrombosis or cerebral embolism, which can develop on the background of well-known population-based risk factors such as hypertension, metabolic syndrome, smoking, heart rhythm disorders, valvular heart disease or in relation to typical obstetric pathologies, such as preeclampsia, massive obstetrical bleeding, septic complications, amniotic fluid embolism. In recent years, there is increasing interest in the role of thrombophilia in the pathogenesis of ischemic stroke, however, data on this issue is even more limited and contradictory than for venous thrombosis. Methods of prevention of recurrent stroke and strategies of pregnancy and delivery management in women with history of ischemic stroke are also contradictory.
Key words: ischemic stroke, pregnancy, thrombophilia, antiphospholipid syndrome, low molecular weight heparin. |
|