ПОКАЗАТЕЛИ СОДЕРЖАНИЯ ГЛИОФИБРИЛЛЯРНОГО КИСЛОГО ПРОТЕИНА В СЫВОРОТКЕ КРОВИ ПОСЛЕ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ В ПЕРИНАТАЛЬНОМ ПЕРИОДЕ
Блинов Д.В. Дата публикации на сайте: 2014-05-15 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
Научный и практический интерес представляет исследование динамики концентрации глиофибриллярного кислого протеина (glial fibrillary acid protein, GFAP) в сыворотке крови в течение 6 месяцев жизни у детей с церебральной ишемией. Материалы и методы. На 1-24-й неделях жизни было обследовано 49 детей с перинатальным гипоксически-ишемическим поражением ЦНС со сроком гестации 32-41 неделя. Контрольную группу составили 28 здоровых доношенных детей. Были сформированы следующие группы сравнения: дети с оценкой по шкале Апгар на 1-й минуте 1-3 балла (группа А 1-3), 4-6 баллов (группа А 4-6) и 7-9 баллов (группа А 7-9); дети с гестационным возрастом (ГВ) ГВ 32-33 недели, ГВ 34-36 недель и ГВ 37-40 недель; дети с внутрижелудочковыми кровоизлияниями (группа ВЖК) и перивентрикулярными лейкомаляциями (группа ПВЛ). Количественный анализ GFAP в сыворотке крови осуществляли методом иммуноферментного анализа (ИФА). Результаты. Зарегистрировано достоверное увеличение содержания GFAP в сыворотке крови на 1-й неделе жизни в группах А 1-3, А 4-6 и А 7-9 по сравнению с контрольной группой. Концентрация GFAP у детей группы ГВ 32-33 значительно превышала таковую в группах ГВ 34-36 и ГВ 37-41, а также в группе контроля. В группах ВЖК и ПВЛ различия на первой неделе не были статистически достоверны, хотя средние значения содержания данного антигена при ПВЛ несколько меньше, чем при ВЖК. Установлен феномен отсроченного повышения концентрации GFAP на 3-й неделе. Заключение. Определение содержания GFAP в сыворотке крови может быть использовано для верификации тяжести и типа повреждения ЦНС у новорожденных различного гестационного возраста.
LEVELS OF GLIAL FIBRILLARY ACIDIC PROTEIN IN SERUM AFTER CEREBRAL ISCHEMIA IN THE NEONATAL PERIOD
Blinov D.V.
The Russian National Research Medical University named after N.I. Pirogov of the Ministry of Health of the Russian Federation, Moscow
Abstract: investigation of dynamics of serum glial fibrillary acid protein (GFAP) concentration within the first 6 months of life of neonates with cerebral ischemia has both scientific and practical implications. Materials and methods. 49 neonates with perinatal hypoxic-ischemic lesion of the CNS and gestational age 32-41 weeks have been examined between the ages of 1 and 24 weeks of life. 28 healthy term infants comprised the control group. The neonates were assigned to one of the following groups: babies with Apgar score of 1-3 points one minute after birth (group A 1-3), 4-6 points (group А 4-6) and 7-9 points (group А 7-9); neonates with gestational age (GA) GA 32-33 weeks, GA 34-36 weeks and GA 37-40 weeks; newborns with intraventricular hemorrhages (IVH group) and periventricular leukomalacia (PVL group). Quantitative analysis of serum GFAP was carried out using the immunoenzymatic assay (IEA). Results. We have found a significantly increases serum GFAP concentration among neonates aged one week in groups А 1-3, А 4-6 and А 7-9 as compared to control group. Serum GFAP concentration in infants of the GA 32-33 group was significantly higher compared to the GA 34-36 and GA 37-41 groups and control group. The differences between the IVH group and PVL group were not significant during the first week of life although the mean GFAP values were somewhat lower in the PVL group compared to the IVH group. We have found the phenomenon of delayed increase of the GFAP concentration in neonates aged 3 weeks. Conclusion. Determination of serum GFAP concentration can be used for the verification of severity and type of CNS lesion in newborns at different gestational ages.
Key words: CNS, hypoxia, ischemia, blood-brain barrier (BBB), neurospecific proteins (NSB), glial fibrillary acid protein (GFAP).
Ключевые слова: ЦНС, гипоксия, ишемия, ГЭБ, нейроспецифические белки, НСБ, глиофибриллярный кислый протеин, GFAP.
Введение
Исследования последних лет подтверждают сохранение интереса к объективной динамической оценке состояния гематоэнцефалического барьера (ГЭБ) и центральной нервной системы (ЦНС) при перинатальном гипоксически-ишемическом поражении ЦНС и других неврологических расстройствах. В этих целях оправданно использовать определение нейроспецифических белков в сыворотке крови и других биологических жидкостях [7,9,11,15].
Повреждение клеток, экспрессирующих данные белки, является причиной повышения их концентраций в биологических жидкостях, и это позволяет использовать их в качестве биологического маркера повреждения нервной системы [5,14]. Глиофибриллярный кислый протеин (glial fibrillary acid protein, GFAP) является одним из наиболее изученных нейроспецифических белков – маркеров состояния астроглиальных клеток. GFAP содержится в глиальных филаментах дифференцированных астроцитов ЦНС.
В предыдущих исследованиях мы выполнили оценку профиля высвобождения GFAP в периферический кровоток у детей с перинатальным гипоксически-ишемическим поражением ЦНС [4]. Тогда методом иммуноферментного анализа (ИФА) было идентифицировано увеличение сывороточной концентрации GFAP в периферической крови на 1-й неделе жизни с последующим повышением на 3-й неделе. Интересно, что повышение уровня GFAP предшествовало повышению уровня другого нейроспецифического антигена – нейроспецифической енолазы, являющегося маркером нейронов. Однако включенные в исследование пациенты не были стратифицированы по гестационному возрасту (ГВ). В более поздних исследованиях была показана разница в сывороточном содержании ряда НСБ у недоношенных детей различного гестационного возраста в сравнении с контрольной группой до трех недель жизни [3]. Однако в доступных для анализа научных статьях существует дефицит данных о содержании GFAP в сыворотке крови новорожденных различного ГВ в течение продолжительного периода времени. Поэтому дополнить полученные результаты собственных исследований таким анализом первичных данных представляется важным с научной и практической точек зрения.
Исходя из этого, целью данной работы явилось исследование динамики концентрации GFAP в сыворотке крови в течение 24 недель жизни у детей с перинатальным гипоксически-ишемическим поражением ЦНС, с ретроспективным пересчетом данных, включая стратификацию по гестационному возрасту.
Материалы и методы
Клинические группы наблюдения
Всего было обследовано 77 детей, находившихся на стационарном лечении и амбулаторном наблюдении в реанимационном и детском отделениях родильного дома № 17 г. Москвы, отделениях патологии новорожденных и катамнеза Детской клинической больницы № 13 им. Н.Ф. Филатова и психоневрологического отделения детской городской больницы № 6 г. Москвы.
В группу с перинатальным гипоксически-ишемическим поражением ЦНС вошли 49 детей со сроком гестации 32-41 неделя. При рождении состояние было оценено как тяжелое у 23 новорожденных (46,9%), среднетяжелое – у 18 детей (36,7%), удовлетворительное – у 8 детей (16,3%). Тяжесть состояния новорожденных в раннем неонатальном периоде была обусловлена как отдельными синдромами дезадаптации, так и их сочетаниями: у всех детей наблюдались проявления перинатального гипоксически-ишемического поражения ЦНС различной степеней тяжести. При этом поражение I степени отмечалось у 10 новорожденных (20,4%), II степени – у 32 (65,3%), а III степени – у 7 (14,3%) детей [2]. У части детей с перинатальным гипоксически-ишемическим поражением ЦНС были диагностированы синдром дыхательных расстройств (СДР), внутриутробная пневмония, конъюгационная гипербилирубинемия I-II степени, общий отечный синдром I-II степени, а также проявления внутриутробной гипотрофии I-II степени.
На основании оценки по шкале Апгар 47 детей с перинатальным гипоксически-ишемическим поражением ЦНС были разделены на следующие группы: дети с оценкой по шкале Апгар на 1-й минуте 1-3 балла (группа А 1-3) – 6 новорожденных; 4-6 баллов (группа А 4-6) – 22 новорожденных и 7-9 баллов (группа А 7-9) – 19 новорожденных.
По массе тела и гестационному возрасту (ГВ) дети были разделены на следующие группы: 12 детей (24,5%) имели ГВ 32-33 недели, средний вес при рождении – 1468,3±36,6 г (диапазон – от 1300 до 1650 г); 15 детей (30,6%) имели ГВ от 34 до 36 недель и среднюю массу 2541,3±106,2 г (диапазон – от 1800 до 3180 г); 22 новорожденных (44,9%) имели ГВ 37-40 недель и среднюю массу 3329,4±136,9 г (диапазон – от 2080 до 4600 г). Средняя оценка по шкале Апгар, отражающая тяжесть состояния, была сходна во всех этих группах и составила на 1-й минуте 5,5-6,7 баллов, на 5-й минуте – 6,8-7,4 балла.
Всем детям проводилась комплексная посиндромная терапия в условиях родильного дома. Все дети, родившиеся в тяжелом состоянии, нуждались в проведении интенсивной терапии в условиях отделения реанимации, включавшей в себя искусственную вентиляцию легких (ИВЛ), а также инфузионную, антибактериальную терапию, поддерживающую или заместительную терапию глюкокортикоидными гормонами.
Лечение осуществлялось под постоянным контролем кислотно-щелочного, а также электролитного состава сыворотки крови. Проводился динамический мониторинг уровней гематокрита, гемоглобина, общего белка, билирубина, глюкозы, мочевины.
Интравентрикулярные кровоизлияния (внутрижелудочковые кровоизлияния, ВЖК) и перивентрикулярные лейкомаляции (ПВЛ) были выявлены и подтверждены у 21 ребенка с помощью чрезродничковой нейросонографии (НСГ), общего анализа крови и исследований люмбального ликвора. На основании полученных данных были сформированы соответствующие группы: группу с преимущественно геморрагическими поражениями ЦНС (группа ВЖК) составили 14 детей, группу с преимущественно ишемическими поражениями ЦНС (группа ПВЛ) – 7 детей.
Контрольная группа была представлена 28 здоровыми доношенными детьми, рожденными в условиях физиологического родильного дома. Дети родились от здоровых матерей с физиологически протекающей беременностью и родами. Срок гестации у детей этой группы составил 38-41 неделю. Средняя масса при рождении равнялась 3510,4±140,2 г, средняя длина тела – 49,4±0,4 см. У всех детей состояние при рождении расценено как удовлетворительное. Оценка по шкале Апгар на первой минуте составила 8-10 баллов. Период ранней постнатальной адаптации у всех детей этой группы протекал удовлетворительно. Выписка домой происходила на 4-5-е сутки жизни в удовлетворительном состоянии.
Количественный иммуноферментный анализ GFAP
Количественный анализ GFAP в сыворотке крови осуществляли иммуноферментным методом [5], с помощью специфических тест-систем, разработанных на основе соответствующих моноклональных антител в лаборатории иммунохимии ГНЦССП им. В.П. Серб-ского. Регистрацию результатов иммуноферментного анализа проводили на одноканальном фотометре Bio-Teck Instruments (США) при длине волны 450 нм.
Статистический анализ проводили с помощью t-критерия Стьюдента, U-критерия с использованием функции Фишера и коэффициента корреляции Пирсона. Расчеты проводили с помощью программного пакета для работы с электронными таблицами Excel 2013 (Microsoft, США).
Результаты клинического исследования
Во всех исследуемых группах была изучена динамика уровня GFAP в сравнении с изменением концентраций данного антигена в сыворотке крови детей контрольной группы.
У детей из группы контроля колебания уровня GFAP были незначительными: максимальное значение не превышало 4,1±0,8 нг/мл.
По сравнению с детьми из группы контроля различия в содержании GFAP в опытных группах А 1-3, А 4-6 и А 7-9 были статистически значимыми (p<0,05) (см. рис. 1). Различия между группами А 1-3 и А 4-6 оказались статистически недостоверными в течение всего исследования.
При динамическом наблюдении уровень GFAP в сыворотке крови у детей из групп А 1-3 и А 4-6 на 3-й неделе достоверно увеличивался до 58,0±8,7 и 50,0±4,4 нг/мл соответственно. В дальнейшем содержание данного антигена постепенно снижалось. Тенденция к увеличению содержания GFAP в сыворотке крови у детей из группы А 1-3 отмечалась также и на 24-й неделе. При этом у детей из группы А 7-9 концентрация GFAP неуклонно снижалась и к 24-й неделе приблизилась к нормальному уровню (см. рис. 1).
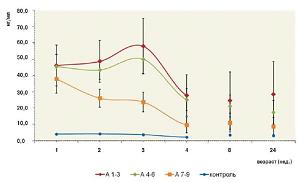 | Рисунок 1: Динамика уровней глиофибриллярного кислого протеина (GFAP) у детей с перинатальным гипоксически-ишемическим поражением ЦНСc различной оценкой по шкале Апгар на 1-й минуте после рождения. |
В группе ГВ 32-33 концентрация GFAP в сыворотке крови на первой неделе составила 52,6±6,5 нг/мл, в группе ГВ 34-36 – 44,6±4,8 нг/мл и в группе ГВ 37-41 – 35,3±2,7 нг/мл, в то время, как в контрольной группе – 4,0±0,8 нг/мл.
За исключением 1-й и 24-й недель в группе ГВ 32-33 концентрация GFAP статистически достоверно различалась с концентрацией данного антигена в группах ГВ 34-36 и ГВ 37-41, а также в контрольной группе. В группах ГВ 34-36 и ГВ 37-41 различия в содержании GFAP с контрольной группой к 24-й неделе наблюдения становились статистически недостоверными, в то время как в группе ГВ 32-33 достоверность сохранялась в течение всего исследования.
При динамическом наблюдении на 3-й неделе в группах ГВ 32-33 и ГВ 34-36 наблюдалось повышение концентрации GFAP в сыворотке крови, причем в группе ГВ 32-33 она превысила значение на 1-й неделе и составила 62,3±4,8 нг/мл. В последующем концентрация GFAP в данных группах неуклонно снижалась (см. рис. 2).
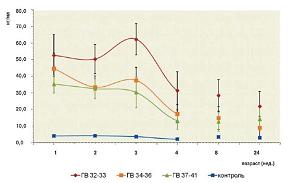 | Рисунок 2: Динамика уровня глиофибриллярного кислого протеина (GFAP) в сыворотке крови у детей различного гестационного возраста (ГВ) с перинатальным гипоксически-ишемическим поражением ЦНС. |
Уровень GFAP у детей с ишемическими и геморрагическими поражениями ЦНС на 1-й неделе жизни также был повышен (см. рис. 3). У детей с ВЖК он составлял 49,1±5,0 нг/мл, у детей с ПВЛ – 38,8±9,7 нг/мл.
По сравнению с группой контроля различия в концентрации GFAP у детей из группы ВЖК были статистически значимы (p<0,05) в течение всего исследования, у детей из группы ПВЛ – до 4-й недели жизни. Различия в уровне GFAP между группами ВЖК и ПВЛ были статистически достоверны, начиная со 2-й недели и до конца исследования (p<0,05).
При динамическом наблюдении концентрация GFAP в группе ВЖК после некоторого снижения на 2-й неделе вновь возвращается на прежний уровень на 3-й неделе жизни, когда этот показатель составил 49,7±6,2 нг/мл (см. рис. 3). Затем происходило снижение содержания GFAP в сыворотке крови до 21,6±4,5 нг/мл и до конца исследования его уровень сохранялся таким же. В группе ПВЛ содержание GFAP в сыворотке крови неуклонно снижалось, и к 8-й неделе уже не отличалось от такового в контроле (см. рис. 3).
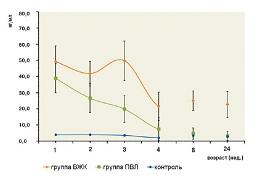 | Рисунок 3: Динамика уровня глиофибриллярного кислого протеина (GFAP) у детей c геморрагическими и ишемическими поражениями ЦНС: группа ВЖК –дети с внутрижелудочковыми кровоизлияниями; группа ПВЛ –дети с перивентрикулярными лейкомаляциями. |
Обсуждение результатов
В ходе исследования было идентифицировано достоверное увеличение содержания GFAP в сыворотке крови на 1-й неделе после перинатального гипоксически-ишемического поражения ЦНС в группах А 1-3, А 4-6 и А 7-9 по сравнению с контрольной группой. То, что на этом сроке уровень GFAP в данных группах примерно одинаков, свидетельствует в пользу процессов массивной очаговой некротической нейродегенерации, преобладающих в течение первых 5-7 суток. В течение всего срока наблюдения концентрации GFAP тем выше, чем выше тяжесть перинатального гипоксически-ишемического поражения, что отражает оценка по шкале Апгар на 1-й минуте (см. рис. 1).
Обращает на себя внимание то, что в течение всего исследования сывороточное содержание GFAP у детей со сроком гестации 32-33 недели значительно превышало концентрацию данного антигена в группах со сроком гестации 34-36 и 37-41 неделя и в группе контроля. Это может быть обусловлено тем, что у недоношенных детей при тех же факторах поражения и одинаковой тяжести состояния вследствие морфофункциональной незрелости структур ГЭБ снижена его способность противостоять повреждающим факторам. Вместе с тем с гестационным возрастом, по-видимому, связана не столько тяжесть перинатального гипоксически-ишемического поражения ЦНС, сколько частота возникновения этого осложнения.
В этих же группах пациентов ранее оценивался уровень NSE в сыворотке крови [1,4]. Следует отметить, что в группе ПВЛ, начиная с 1-й недели эксперимента, он достоверно меньше, чем в группе ВЖК. Различия же в уровне GFAP на первой неделе, напротив, статистически недостоверны, хотя средние значения содержания данного антигена при ПВЛ и несколько меньше, чем при ВЖК (см. рис. 3). Астроциты, как известно, формируя структуру ГЭБ, непосредственно взаимодействуют с эндотелиоцитами сосудов, вследствие чего GFAP, в отличие от NSE, из поврежденной клетки может сразу элиминировать в кровеносное русло. Содержание GFAP при ПВЛ неуклонно снижается и, начиная с 4-й недели, также достоверно не отличается от контрольных значений, в то время как при ВЖК статистически значимые различия сохранены в течение всего периода наблюдения.
Значимая элиминация в периферический кровоток GFAP на 1-й неделе, по-видимому, является следствием первичного повреждения ГЭБ. Повторное повышение проницаемости ГЭБ для GFAP имело место в более позднем периоде наблюдения. Примечательно, что повышение содержания GFAP опережало увеличение концентрации NSE. В клинических группах увеличение концентрации GFAP и NSE регистрировалось на 3-й и 4-й неделе соответственно. Это подтверждает теорию о том, что каскад последовательно развивающихся патологических процессов, запущенный во время перинатального гипоксически-ишемического повреждения, продолжает в дальнейшем воздействовать на клетки нервной ткани. После начальной стадии повреждения, когда происходит высвобождение во внеклеточное пространство возбуждающих аминокислот, перегрузка клеток ионами кальция, повышение концентрации свободных радикалов, наступает стадия воспаления, характеризующаяся лимфокиновой активацией глиальных клеток, миграцией макрофагов крови в поврежденную ткань, что, в свою очередь, сопровождается секрецией биологически активных веществ с провоспалительными, цитотоксическими и адгезивными свойствами [6,7,8,12]. Образовавшиеся диффузные и очаговые повреждения ткани мозга различной степени тяжести в своем генезе проходят различные стадии развития (резорбции, соединительно-тканной организации и кистообразования с исходами в глиозные рубцы, полости, гидроцефалию и атрофию мозга [13,16], что сопровождается высвобождением в кровоток нейробиологических маркеров, в т.ч. GFAP. Продолжающееся воздействие секретируемых провоспалительных и цитотоксических биологически активных веществ приводит к гибели нейронов, окружающих фокусы инфаркта (т.н. зона penumbra).
Полученные данные позволяют проводить объективную оценку патологического процесса, развивающегося при перинатальном гипоксически-ишемическом поражении ЦНС, в частности – состояние проницаемости ГЭБ. Кроме этого, определение содержания GFAP в сыворотке крови может быть использовано для биохимической верификации тяжести и типа повреждения ЦНС у новорожденных различного гестационного возраста.
Литература:
1. Блинов Д.В. Оценка проницаемости ГЭБ для нейроспецифической енолазы при перинатальном гипоксически-ишемическом поражении ЦНС. Акушерство, гинекология и репродукция. 2013; 4: 15-19.
2. Классификация перинатальных поражений нервной системы у новорожденных. Методические рекомендации. М. 2000; 40 с.
3. Голосная Г.С. Нейрохимические аспекты патогенеза гипоксических поражений мозга у новорожденных. Автореф. дисс. …докт. мед. наук. 2005; 48 с.
4. Рогаткин С.О, Блинов Д.В., Володин Н.Н., Гурина О.И., Семенова А.В., Лебедев С.В., Петров С.В., Чехонин В.П. Перспективы применения иммуноферментного анализа нейроспецифических антигенов в перинатальной неврологии (клинико-экспериментальное исследование). Вопросы гинекологии, акушерства и перинатологии. 2003; 2 (4); 8-15.
5. Чехонин В.П., Дмитриева Т.Б., Жирков Ю.А. Иммунохимический анализ нейроспецифических антигенов. М., 2000.
6. Almini R., Levy T.J., Han B.H., Shan A.R., Gidday J.M., David M. Holtzman D.M. BDNF protect against spatial memory deficit following neonatal hypoxia-ischemia. Experimental neurology. 2000; 166: 99-114.
7. Berger R., Garnier Y. Pathophysiology of perinatal brain damage. Brain Res. Rew. 1999; 30: 107-134.
8. Blennow M., Hagberg H., Rosengren L. Glial fibrillary acidic protein in the cerebrospinal fluid: a possible indicator of prognosis in full-term asphyxiated newborn infants? Pediatr. Res. 1995; 37 (3): 260-264.
9. Blennow M., Savman K., Ilves P., Thoresen M., Rosengren L. Brain-specific proteins in the cerebrospinal fluid of severely asphyxiated newborn infants. Acta Paediatr. 2001; 90: 1171-1175.
10. Elimian A., Figueroa R., Verma U., Visintainer P., Sehgal P, Tejani N. Amniotic fluid neuron-specific enolase: a role in predicting neonatal neurologic injury? Obst. Gynecol. 1998; 92 (1): 546-550.
11. Herrmann M., Curio N., Jost S., Wunderlich M.T., Synowitz H., Wallesch C.W. Protein S-100B and neuron specific enolase as early neurobio-chemical markers of the severity of traumatic brain injury. Restor Neurol Neurosci. 1999; 14: 109-114.
12. Kermer P., Klocker N., Bahr M. Neuronal death after brain injury (models, mechanisms, and therapeutic strategies in vivo). Cell. Tissue Res. 1999; 298: 383-395.
13. Leviton A., Fenton T., Kuban K.C., Pagano M. Labor and delivery characteristics and the risk of germinal matrix hemorrhage in low birth weight infants. J. Child-Neurol. 1991 Jan; 6 (1): 35-40.
14. Missler U., Wiesmann M., Friedrich C., Kaps M. S-100 protein and neuron-specific enolase concentrations in blood as indicators of infarction volume and prognosis in acute ischemic stroke. Stroke. 1997; 28: 1956-1960.
15. Nagdyman N., Kцmen W., Ko H., Muller C., Obladen M. Early Biochemical Indicators of Hypoxic-Ischemic Encephalopathy after Birth Asphyxia. Pediatric Research. 2001; 49 (4).
16. Volpe J.J. Neurology of the Newborn. Saunders, Philadelphia. 2001.
References:
1. Blinov D.V. Ocenka pronicaemosti GJeB dlja nejrospecificheskoj enolazy pri perinatalnom gipoksicheski-ishemicheskom porazhenii CNS. Akusherstvo, ginekologija i reprodukcija. 2013; 4: 15-19.
2. Klassifikacija perinatalnyh porazhenij nervnoj sistemy u novorozhdennyh. Metodicheskie rekomendacii. M. 2000; 40 s.
3. Golosnaja G.S. Nejrohimicheskie aspekty patogeneza gipoksicheskih porazhenij mozga u novorozhdennyh. Avtoref. diss. …dokt. med. nauk. 2005; 48 s.
4. Rogatkin S.O, Blinov D.V., Volodin N.N., Gurina O.I., Semenova A.V., Lebedev S.V., Petrov S.V., Chehonin V.P. Perspektivy primenenija immunofermentnogo analiza nejrospecificheskih antigenov v perinatalnoj nevrologii (kliniko-jeksperimentalnoe issledovanie). Voprosy ginekologii, akusherstva i perinatologii. 2003; 2 (4); 8-15.
5. Chehonin V.P., Dmitrieva T.B., Zhirkov Ju.A. Immunohimicheskij analiz nejrospecificheskih antigenov. M., 2000.
6. Almini R., Levy T.J., Han B.H., Shan A.R., Gidday J.M., David M. Holtzman D.M. BDNF protect against spatial memory deficit following neonatal hypoxia-ischemia. Experimental neurology. 2000; 166: 99-114.
7. Berger R., Garnier Y. Pathophysiology of perinatal brain damage. Brain Res. Rew. 1999; 30: 107-134.
8. Blennow M., Hagberg H., Rosengren L. Glial fibrillary acidic protein in the cerebrospinal fluid: a possible indicator of prognosis in full-term asphyxiated newborn infants? Pediatr. Res. 1995; 37 (3): 260-264.
9. Blennow M., Savman K., Ilves P., Thoresen M., Rosengren L. Brain-specific proteins in the cerebrospinal fluid of severely asphyxiated newborn infants. Acta Paediatr. 2001; 90: 1171-1175.
10. Elimian A., Figueroa R., Verma U., Visintainer P., Sehgal P, Tejani N. Amniotic fluid neuron-specific enolase: a role in predicting neonatal neurologic injury? Obst. Gynecol. 1998; 92 (1): 546-550.
11. Herrmann M., Curio N., Jost S., Wunderlich M.T., Synowitz H., Wallesch C.W. Protein S-100B and neuron specific enolase as early neurobio-chemical markers of the severity of traumatic brain injury. Restor Neurol Neurosci. 1999; 14: 109-114.
12. Kermer P., Klocker N., Bahr M. Neuronal death after brain injury (models, mechanisms, and therapeutic strategies in vivo). Cell. Tissue Res. 1999; 298: 383-395.
13. Leviton A., Fenton T., Kuban K.C., Pagano M. Labor and delivery characteristics and the risk of germinal matrix hemorrhage in low birth weight infants. J. Child-Neurol. 1991 Jan; 6 (1): 35-40.
14. Missler U., Wiesmann M., Friedrich C., Kaps M. S-100 protein and neuron-specific enolase concentrations in blood as indicators of infarction volume and prognosis in acute ischemic stroke. Stroke. 1997; 28: 1956-1960.
15. Nagdyman N., Kцmen W., Ko H., Muller C., Obladen M. Early Biochemical Indicators of Hypoxic-Ischemic Encephalopathy after Birth Asphyxia. Pediatric Research. 2001; 49 (4).
16. Volpe J.J. Neurology of the Newborn. Saunders, Philadelphia. 2001.
LEVELS OF GLIAL FIBRILLARY ACIDIC PROTEIN IN SERUM AFTER CEREBRAL ISCHEMIA IN THE NEONATAL PERIOD
Blinov D.V.
The Russian National Research Medical University named after N.I. Pirogov of the Ministry of Health of the Russian Federation, Moscow
Abstract: investigation of dynamics of serum glial fibrillary acid protein (GFAP) concentration within the first 6 months of life of neonates with cerebral ischemia has both scientific and practical implications. Materials and methods. 49 neonates with perinatal hypoxic-ischemic lesion of the CNS and gestational age 32-41 weeks have been examined between the ages of 1 and 24 weeks of life. 28 healthy term infants comprised the control group. The neonates were assigned to one of the following groups: babies with Apgar score of 1-3 points one minute after birth (group A 1-3), 4-6 points (group А 4-6) and 7-9 points (group А 7-9); neonates with gestational age (GA) GA 32-33 weeks, GA 34-36 weeks and GA 37-40 weeks; newborns with intraventricular hemorrhages (IVH group) and periventricular leukomalacia (PVL group). Quantitative analysis of serum GFAP was carried out using the immunoenzymatic assay (IEA). Results. We have found a significantly increases serum GFAP concentration among neonates aged one week in groups А 1-3, А 4-6 and А 7-9 as compared to control group. Serum GFAP concentration in infants of the GA 32-33 group was significantly higher compared to the GA 34-36 and GA 37-41 groups and control group. The differences between the IVH group and PVL group were not significant during the first week of life although the mean GFAP values were somewhat lower in the PVL group compared to the IVH group. We have found the phenomenon of delayed increase of the GFAP concentration in neonates aged 3 weeks. Conclusion. Determination of serum GFAP concentration can be used for the verification of severity and type of CNS lesion in newborns at different gestational ages.
Key words: CNS, hypoxia, ischemia, blood-brain barrier (BBB), neurospecific proteins (NSB), glial fibrillary acid protein (GFAP). |
|