СИСТЕМАТИЧЕСКИЙ АНАЛИЗ ФУНДАМЕНТАЛЬНЫХ И КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ, КАК ОБОСНОВАНИЕ НЕОБХОДИМОСТИ СОВМЕСТНОГО ИСПОЛЬЗОВАНИЯ ЭСТРОГЕНСОДЕРЖАЩИХ ПРЕПАРАТОВ С ПРЕПАРАТАМИ МАГНИЯ И ПИРИДОКСИНА
Громова О.А.1,2, Лиманова О.А.2, Торшин И.Ю.1 Дата публикации на сайте: 2013-11-26 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
В современной гинекологии для заместительной гормональной терапии (ЗГТ) широко используются эстрогенсодержащие препараты, как оральные контрацептивы (ОК), так и другие. По данным крупномасштабных клинико-эпидемиологических исследований, прием эстрогеновых препаратов, даже т.н. «низкодозированных», связан с определенными побочными эффектами и с повышенным риском тромбоэмболических заболеваний (ишемический инсульт, инфаркт миокарда), рака молочной железы и смертности от осложнений со стороны сердечно-сосудистой системы. Имеющиеся данные подтверждают негативное воздействие эстрогенов на обмен витамина В6 и магния. Оба микронутриента характеризуются доказанным положительным воздействием на здоровье человека и снижают, в частности, риск ишемического инсульта, инфаркта миокарда и сердечно-сосудистой смертности. Поэтому часть побочных эффектов эстрогеновых препаратов может быть устранена или существенно снижена при ведении курсов ЗГТ и ОК на фоне приема препаратов магния и пиридоксина. В настоящей работе представлены результаты систематического анализа данных фундаментальных и клинико-эпидемиологических исследований по влиянию эстрогенов на обмен витамина В6 и магния. Результаты анализа указывают на необходимость поддержания адекватных уровней магния и пиридоксина в организме для осуществления физиологических и предупреждения патологических эффектов эстрогенов. Представлены детальные молекулярные механизмы осуществления обсуждаемых взаимодействий. Показана перспективность использования препаратов пиридоксина и магния в терапии эстрогензависимых заболеваний.
SYSTEMATIC ANALYSIS OF FUNDAMENTAL AND CLINICAL RESEARCH, AS JUSTIFICATION FOR THE USE OF ESTROGEN-CONTAINING DRUGS WITH THE PREPARATIONS OF MAGNESIUM AND PYRIDOXINE
Gromova O.A. , Limanova O.A. , Torshin I.Yu.
Russian Satellite Center, Trace Element Institute for UNESCO, Moscow
2 Ivanovo State Medical Academy, Ministry of Public Health of the Russian Federation
Abstract: estrogen-containing preparations are widely used in gynecology today for hormone replacement therapy (HRT), as oral contraceptives (OC) and otherwise. Data obtained in large-scale clinical-epidemiological studies showed that intake of estrogen preparations, even of the so-called low-dose ones is associated with certain side effects and with heightened risk of thromboembolism-associated conditions (ischemic stroke, myocardial infarction), of breast cancer and of mortality from cardiovascular events. Available data indicate that estrogens exert negative influence upon metabolism of vitamin В6 and magnesium. Both micronutrients produce proven positive impact upon human health, reducing, in particular, the risk of ischemic stroke, myocardial infarction and cardiovascular mortality. Therefore then, part of side effects of estrogen preparations could be eliminated or significantly reduced if HRT and OC are carried out with background intake of magnesium preparations and pyridoxine. This paper presents results of systematic analysis of data from fundamental and clinical-epidemiological studies of the influence of estrogens on metabolism of vitamin В6 and magnesium. Results of the analysis indicate that maintaining adequate levels of magnesium and pyridoxine in the body is indispensable for implementation of physiological effects and prevention of pathological effects of estrogens. Detailed description of molecular mechanisms of the discussed interactions is presented. Promising results of use of magnesium preparations and pyridoxine in treatment of estrogen-dependent conditions are shown.
Key words: treatment with estrogens, magnesium citrate, pyridoxine, COC, HRT.
Ключевые слова: терапия эстрогенами, цитрат магния, пиридоксин, системная биология, биоинформатика.
1 РСЦ Института Микроэлементов ЮНЕСКО, Москва
2 ГБОУ ВПО «Ивановская Государственная Медицинская Академия МЗ РФ»
Введение
Широкое использование эстрогенсодержащих препаратов обуславливает необходимость их эффективного и безопасного применения. Для достижения эффективности и максимального снижения риска побочных эффектов врач подбирает индивидуальный курс терапии для каждой пациентки: ежедневное дозирование эстрогенов и определенную форму препарата (таблетки, пластырь, гель, свечи, в/в введение и др.). В клинической фармакологии подавляющее большинство исследований направлены на достижение баланса «эффективность-безопасность» за счет варьирования доз и химических форм эстрогенов, изменения соотношения эстроген:прогестаген в препарате и т.п. [7].
В большинстве клинических исследований эстрогеновых препаратов при анализе эффективности и интенсивности проявления побочных эффектов практически никогда не учитывается состояние витаминно-минерального обмена индивидуальных пациентов. Среди 30 известных современной медицине эссенциальных нутриентов особенно следует отметить магний и витамин В6, обеспеченность которыми играет колоссальную роль в поддержании здоровья человека [57]. В настоящей работе комплекс взаимодействий между эстрогенами, магнием и витамином В6 рассматривается на основе нескольких уровней: молекулярно-биологическом, фармакологическом и с точки зрения экспериментальных и клинических исследований.
Следует отметить, что между эстрогенами, с одной стороны, и магнием и пиридоксином, с другой, имеются отношения физиологического антагонизма: эстрогены способствуют снижению обеспеченности организма этими двумя нутриентами. Уровни магния достоверно снижаются во время эстрогеновой (фолликулярной) фазы менструального цикла и обратно пропорционально уровням эстрогена в сыворотке [44]. Повышенный уровень эстрогенов в плазме крови также способствует выведению из организма витамина В6 [63].
Естественный, физиологический антагонизм между эстрогенами, магнием и пиридоксином существенно усугубляется при пероральном приеме эстрогенсодержащих препаратов, когда концентрации активных эстрогенов в крови и в других тканях могут существенно превышать физиологически допустимые уровни. С одной стороны, это приводит к таким широко известным побочным эффектам эстрогеновых препаратов, как тошнота, головная боль, рвота, головокружение, депрессия и раздражительность. С другой стороны, прием эстрогеновых препаратов соответствует существенному повышению риска хронической патологии.
Например, в рандомизированном многоцентровом исследовании, проведенном в рамках крупномасштабной исследовательской программы США, известной как «Women Health Initiative» (WHI, «Инициатива: Женское Здоровье»), 15730 женщин в возрасте 50-79 лет получали ЗГТ (0,625 мг/сут. конъюгированных эстрогенов, 2,5 мг/сут. медроксипрогестерон ацетата) в течение 3 лет. Результаты исследования указали на достоверное повышение риска ряда заболеваний, включая тромбоэмболию, рак молочной железы (О.Ш.=1,5), эндометрия, колоректальный рак и общую смертность (Heiss, 2008) [29].
Эти и другие побочные эффекты эстрогенсодержащих препаратов могут быть существенно снижены при приеме препаратов магния и пиридоксина (один из витамеров В6). Например, профилактическое лечение остеопороза в постменопаузе препаратами эстрогенов, препаратами кальция или их сочетанием совершенно упускает из виду тот факт, что избыток каждого из этих действующих начал увеличивает потребность организма в магнии и способствует снижению уровней магния в крови. Высокие дозы эстрогенов и кальция также вызывают резкое увеличение свертывания крови и нарушение кровообращения. Компенсация дефицита магния нормализует процессы свертывания крови и фибринолиза за счет участия в регулировке гемостаза, метаболизма липидов и простагландинов [55].
Пиридоксин – одна из форм витамина В6 – является синергистом магния, способствуя более полноценному усвоению магния из пищи и фармацевтических препаратов. Различные формы витамина В6 (пиридоксин, пиридоксаль, пиридоксальфосфат) являются эндогенными кофакторами более 100 ферментов организма человека, участвующих в образовании эритроцитов, метаболизме нейромедиаторов, усвоении глюкозы, обмене жиров, функционировании печени. Многочисленные исследования показывают, что хронический дефицит пиридоксина способствует развитию самых разных хронических заболеваний, а применение препаратов пиридоксина в сочетании с магнием перспективно для поддержки функции почек, сохранения структуры костей, снижения воспаления, онкопротекции, при депрессии и предменструальном синдроме, а также для профилактики диабета и сердечно-сосудистой патологии. Пиридоксин облегчает симптоматику предменструального синдрома (ПМС), ассоциированную с повышенными уровнями эстрогенов в первую фазу цикла [8,18] (уровень доказательности «А»).
Далее последовательно рассмотрены молекулярные механизмы физиологического воздействия эстрогенов, побочные эффекты эстроген-содержащих препаратов, связанные с дефицитами магния и витамина В6, физиология и молекулярная фармакология этих двух микронутриентов, участие пиридоксина и магния в осуществлении биологических эффектов эстрогенов, негативные эффекты эстрогенсодержащих препаратов на баланс витамина В6 и магния. Показаны перспективы использования препаратов магния и пиридоксина в терапии состояний, связанных с дисбалансом эстрогенов.
Молекулярные механизмы воздействия эстрогенов
Менструальный цикл является результатом комплексного гормонального регулирования. Основными гормонами, регулирующими менструальный цикл, являются гонадотропин-освобождающий гормон (ГнВГ), фолликулостимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ), эстрогены и прогестерон. ГнВГ, ФСГ и ЛГ являются белками. ГнВГ секретируется гипоталамусом, гонадотропины ФСГ и ЛГ – передними долями гипофиза, эстрогены и прогестерон – яичниками. ГнВГ стимулирует секрецию ЛГ и ФСГ, которые, в свою очередь, стимулируют уровни эстрогенов и прогестерона. В отличие от трех гормонов (ГнВГ, ФСГ, и ЛГ), эстрогены (и прогестерон) являются стероидами (терпеноидными липидами с четырьмя кольцами углеродного скелета (см. рис. 1).
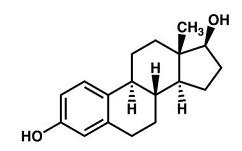 | Рисунок 1: Структурная формула эстрадиола, одного из основных активных эстрогенов. |
Эстрогены присутствуют у мужчин и женщин, но в разных количествах. У женщин эстрогены присутствуют в значительно более высоких концентрациях и необходимы для нормального физического развития женского организма и установления регулярного менструального цикла. В частности, эстрогены ускоряют переработку жировой ткани, приводят к увеличению пролиферации эндометрия, уменьшают ресорбцию костевой ткани остеокластами, участвуют в регуляции водно-минерального обмена. Физиологические уровни эстрогенов необходимы для созревания фолликулов. У женщин репродуктивного возраста эстрогены производятся в основном в яичниках, у беременных – желтым телом, а у женщин в перименопаузе активируется синтез эстрогенов в жировой ткани передней брюшной стенки живота.
Эстрадиол (см. рис. 1) является наиболее сильно-действующим и наиболее распространенным эстрогеном. Физиологическое действие эстрадиола включает индукцию ФСГ и ЛГ-рецепторов в клетках гранулозы, пролиферацию текальных клеток фолликула (формирующих слой связующей ткани вокруг яйцеклетки), а также пролиферацию клеток эндометрия. При очень высоких уровнях эстрадиол дополнительно стимулирует секрецию ЛГ и ФСГ.
В настоящее время предлагаются три внутриклеточных механизма опосредования биологического действия эстрогенов [10-16]. Первый механизм опосредован эстроген-рецепторами (ER-α, ER-β, гены ESR1, ESR2), которые активируются при связывании эстрогена и затем связывают специфические участки ДНК, известные под названием «эстроген-реагирующие элементы» (ERE). Связывание рецепторов с ДНК инициализирует транскрипцию через взаимодействие с рядом белков коактиваторов/корепрессоров.
Согласно второму механизму активированный эстрогеновый рецептор изменяет активность других транскрипционных факторов (например, AP1, NFkB или SP-1). Третий, гипотетический, механизм известен под названием «внегеномный механизм». Это подразумевает влияние эстрогенов не через «геномные» рецепторы, взаимодействующие с ERE в геноме, а, например, активацию G-белокзависимого рецептора GPCR30 [51] или влияние рецептора эстрогена на внутриклеточные сигнальные каскады путем взаимодействия с адаптерными сигнальными белками, такими как Shc и p130Cas [13,36].
Тем не менее, ERE-опосредованный механизм действия эстрогенов – наиболее общий и наиболее очевидный механизм, непосредственно влияющий на экспрессию сотен генов. При связывании молекулы эстрогена на поверхности клетки ER-рецепторы димеризуются и транспортируются в ядро клетки, где они связываются с эстрогенреагирующими элементами «ERE» в составе геномной ДНК (последовательность 5-AGGTCANNNTGACCT-3, где N – любой нуклеотид). Каждая молекула эстроген-рецептора состоит из трех доменов: N-концевого модулирующего домена, C-концевого эстрогенсвязывающего домена и среднего ДНК-связывающего домена (содержащего фрагменты типа «цинковый палец» (см. рис. 2). Последний факт имеет огромное значение для любой терапии эстрогенсодержащими препаратами и другими стероидными препаратами (в т.ч. глюкортикоидами). Цинк абсолютно необходим для активации ДНК-связывающих доменов рецепторов и, на фоне дефицита цинка, активация транскрипции будет резко замедленна даже при связывании рецептором стероида-агониста. Иначе говоря, с точки зрения активности рецептора, дефицит цинка имеет такой же функциональный эффект, как и дефицит стероидных гормонов.
 | Рисунок 2: Доменная структура стероидных (в т.ч. эстрогеновых) рецепторов. |
Именно этот ERE-опосредованный механизм действия эстрогенов и осуществляет подавляющее большинство эффектов эстрогенов, включая побочные эффекты эстроген-содержащих препаратов (оральные контрацептивы, гормонзаместительная терапия) и негативные влияния на уровни магния и витамина В6 в организме. В одном из следующих разделов статьи будут рассмотрены полученные в настоящей работе результаты полногеномного анализа эффектов эстрогенов, непосредственно указывающие на необходимость обеспеченности организма магнием и витамином В6 для осуществления биологических эффектов эстрогенов.
О побочных эффектах эстрогенсодержащих препаратов, потенциально связанных с дефицитом магния и пиридоксина
При использовании эстрогенсодержащих препаратов зачастую происходит превышение уровня эстрогенов, допустимого для той или иной ткани организма. В первую очередь, при пероральном приеме эстрогеновых препаратов молекулы эстрогенов проходят через печеночный метаболизм (чего не происходит в норме, когда эстрогены синтезируются непосредственно в яичниках или в жировой ткани). Как результат, активируется описанный выше ERE-опосредованный механизм действия эстрогенов, и в печени происходят сложные изменения экспрессии генов, которые и приводят к нежелательным побочным эффектам оральных контрацептивов (ОК).
Анализ использования ОК в когорте 6676 женщин 18-30 лет из Дании, Франции, Италии, Португалии и Великобритании указал на такие связанные с прием эстрогенов побочные эффекты, как тошнота (ОШ=1,4), прорывные кровотечения и аменорея (ОШ=1,3), изменения настроения (ОШ=1,8), увеличение веса (ОШ=1,4). Наличие у индивидуальной пациентки нескольких побочных эффектов существенно повышало вероятность прекращения перорального приема эстрогенсодержащих препаратов (1 побочный эффект – на 50%; 2 – на 220% и 3 – на 320%) [53].
При приеме эстрогенов в таблетированном виде они обязательно метаболизируются в печени, что приводит к увеличению экспрессии генов, кодирующих ряд белковых факторов свертывания крови [58]. В результате существенно повышается склонность пациенток к тромбообразованию, особенно при наличии у них определенных вариантов полиморфизмов генов F2 (протромбин), F5 (фактор свертывания 5), F12 (фактор Хагемана), TFPI (ингибитор пути тканевого фактора), FGB (бета-фибриноген), ITGB3 (интегрин бета-3) и других [59].
Негативное влияние «низкодозированных» эстрогенов в составе ОК на свертывание крови иллюстрируют результаты ретроспективного исследования, проведенного в Дании. Исследование случай-контроль включало 794 женщин в возрасте 15-44 лет, перенесших церебральное тромбоэмболическое событие и 1198 участниц в группе контроля. Многофакторный анализ, с учетом поправок на возраст, курение и уровень образования показал, что прием форм эстрогена внутрь даже в дозе 50 мкг/сут. связан с повышением риска церебральной тромбоэмболической атаки в 2,9 раз (95% ДИ 1,6-5,4). Использование препаративных форм, содержащих 30-40 мкг эстрогена, приводило к повышению риска в 1,8 раз (95% ДИ 1,1-2,9), и только препараты, вообще не содержащие эстрогенов (только прогестагены), не приводили к повышению риска (ОШ 0,9 (95%) ДИ 0,4-2,4). Таким образом, прием даже «низкодозированых» ОК связан с существенным повышением риском цереброваскулярных осложнений [37].
Крупномасштабные эпидемиологические исследования, проводимые с начала 1970-х гг., многократно подтверждали взаимосвязь перорального приема эстрогенов с сердечно-сосудистой и цереброваскулярной патологией. Например, совместный анализ результатов исследований «Oral Contraceptive Study» (1974 г., 46000 женщин старше 15 лет, 50% использовали ОК), «Oxford Family Planning Association Contraceptive Study» (1976 г., 17032 женщин 25-39 лет, 56% использовали ОК) и «Walnut Creek Contraceptive Drug Study» (1981 г., 16638 женщин в возрасте 18-54 лет, 28% использовали ОК на момент исследования, 33% когда-то использовали ОК) показал: 1) текущее использование ОК повышает риск ишемического инсульта (ИИ) в 4-5 раз; 2) сам факт использования ОК когда-то в прошлом также связан с повышенными риском ИИ (в 2 раза). Прием пероральных ОК также связан с 2-кратным увеличением риска инфаркта миокарда (ИМ), 5-кратным увеличением венозной тромбоэмболии и атеросклероза [50].
У курильщиц, принимающих ОК, резко возрастает риск сердечно-сосудистой смертности. Оценки риска, связанные с приемом низкодозированных ОК, были сделаны на основании статистики смертности по всему населению США. Смертность при использовании контрацептивов некурящими в возрастной группе от 15 до 34 лет составил 0,06 случаев на 100000, а в возрастной группе от 35 до 44 лет – 3 случая на 100000. У курильщиц смертность многократно возрастала и составила 1,73 случаев на 100000 человек (15-34 лет) и 19,4 случаев на 100000 в группе от 35 до 44 лет [54].
Таким образом, прием эстрогенсодержащих препаратов внутрь характеризуется доказанным риском цереброваскулярной и сердечно-сосудистой патологии, а также онкологических заболеваний (см. введение). Приводимые ниже данные по взаимосвязи молекулярных механизмов физиологического действия витамина В6 и магния с активностью эстрогеновых рецепторов доказывают, что дефицит магния и пиридоксина может и в самом деле существенно усиливать побочные эффекты эстрогенсодержащих препаратов.
Витамин В6: физиология и молекулярная фармакология
Термином витамин В6 обозначаются три основных витамера – пиридоксин (пиридоксол), пиридоксаль и пиридоксамин (см. рис. 3), а также продукты биотрансформаций этих витамеров в организме. В процессе пищеварения в печени и почках эти формы витамина В6 фосфорилируются до пиридоксинфосфата, пиридоксальфосфата и пиридоксаминфосфата. В крови осуществляется превращение пиридоксина в пиридоксамин и, также, в конечный продукт обмена – пиридоксиловую кислоту, которая выделяется с мочой и служит одним из биохимических маркеров обмена пиридоксина/витамина В6.
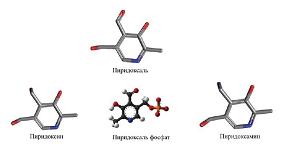 | Рисунок 3: Основные формы витамина В6. |
Витамин В6 является эссенциальным микронутриентом и для него установлены нормы потребления. В России рекомендуемое суточное потребление витамина B6 в расчете на пиридоксин (т.е. пиридоксол, см. рис. 1) составляет 2-2,5 мг/сут. для мужчин, 1,8-2 мг/сут. для женщин (беременные – 2,3 мг/сут., кормящие – 2,5 мг/сут.). Данные нормы рассчитаны на здоровых людей, получающих диету, сбалансированную по макро- и микронутриентам; при нарушениях диеты, стрессе, различных заболеваниях потребность организма в пиридоксине возрастает. В клинической практике дефицит витамина B6 (диагноз Е53.1 «Недостаточность пиридоксина» по МКБ-10) обусловлен, зачастую, ятрогенными причинами, например, приемом гормональных препаратов на основе эстрогенов, способствующих активному выведению витамина В6 из организма [10]. Большая физическая нагрузка, беременность, длительный избыток в питании белков, содержащих значительные количества триптофана, метионина, цистеина, прием медикаментов, подавляющих обмен пиридоксина в организме (в частности, средств для лечения туберкулеза – фтивазида, циклосерина, изониазида и др.), кишечная инфекция, гепатит, лучевая болезнь – все эти и многие другие факторы способствуют возникновению дефицита витамина В6. Витамин В6 практически не имеет «депо» в организме и полная элиминация витамина В6 из диеты приводит к появлению клинической картины гиповитаминоза В6 уже на 5-7-е сутки.
Признаки гиповитаминоза В6 включают такие разнородные проявления, как раздражительность/заторможенность, снижение аппетита/тошнота, сухие дерматиты, гипохромная анемия, склеротические изменения сосудов. В психиатрии описано состояние В6-зависимой тревожности. При этом дефицит пиридоксина часто сопровождается дефицитом магния. Во время обследования пациента врачу следует обратить внимание на следующие проявления, ассоциированные с гиповитаминозом В6: себорейноподобный дерматит на лице, сухие дерматиты в области носогубной складки, над бровями, около глаз, иногда на шее и волосистой части головы; хейлоз с вертикальными трещинами губ; появление глоссита, ангулярный стоматит и др. Эти и другие клинические признаки недостаточности витамина В6 проявляются достаточно быстро, в течение нескольких недель потребления витамин-В6-дефицитной диеты или усиленного выведения производных пиридоксина из организма вследствие упоминаемых ранее ятрогенных и прочих факторов.
В целом, клинические признаки и симптомы дефицита витамина В6 не обладают высокой специфичностью [24,57], поэтому одним из основных показателей дефицита витамина в организме является определение уровней различных производных витамина В6 в плазме крови. Три биохимических теста получили наибольшее распространение: коэффициент активации фермента аспартатаминотрансферазы эритроцитов, уровни пиридоксальфосфата плазмы (ПФП) и содержание в моче пиридоксовой кислоты, продукта биотрансформаций пиридоксина [35]. Определение уровня ПФП используется наиболее широко, так как отражает содержание активной формы витамина в тканях. Уровни ПФП менее 10 нмоль/л указывают на глубокий дефицит витамина В6, а уровень ПФП в 20 н моль/л считается нижней границей нормального содержания [38].
Каким образом дефицит пиридоксина воздействует на физиологические процессы? Фундаментальные исследования показали, что различные формы витамина В6 (прежде всего пиридоксальфосфат) являются эндогенными кофакторами более 100 ферментов организма человека [57]. Витамин В6 необходим для метаболизма углеводов, белков и жиров, улучшает использование организмом ненасыщенных жирных кислот, благотворно влияет на функции нервной системы, печени, кроветворения. В частности, пиридоксальфосфат является кофактором фермента цистатионин бета-синтазы, дефицит пиридоксина приводит к гипергомоцистеинемии.
Европейский орган по продовольственной безопасности (European Food Safety Authority, EFSA), который предоставляет научные консультации на государственном уровне, подтверждает, что диетарное потребление витамина B6 способствует [20]:
• нормализации белкового и гликогена метаболизма;
• функционированию нервной и иммунной системы;
• регулированию гормональной активности;
• нормализации кроветворения (формирование эритроцитов);
• метаболизму гомоцистеина;
• метаболизму цистеина;
• энергетическому метаболизму;
• обмену нейромедиаторов;
• снижению усталости и утомления.
Известный из фундаментальных исследований широкий спектр воздействия витамина В6 на молекулярно-физиологические процессы обуславливает достаточно большой круг клинических проявлений дефицита пиридоксина и его производных, так что восполнение дефицита витамина В6 полезно в терапии самых разных хронических заболеваний. Систематический анализ более 10000 исследований по молекулярным, экспериментальным и клиническим эффектам пиридоксина позволяет утверждать, что применение препаратов пиридоксина в сочетании с магнием перспективно для поддержки функции почек, сохранения структуры костей, снижения воспаления, онкопротекции, при депрессии и предменструальном синдроме, а также для профилактики диабета и сердечно-сосудистой патологии. В большинстве рассмотренных клинических применений эффективная терапия достигается при назначении пиридоксина в дозах 25-50 мг/сут., а увеличение дозировки не приводит к сколько-нибудь заметному усилению эффекта [8].
Подчеркнем, что такие клинические применения препаратов пиридоксина, как профилактика онкологических заболеваний, регуляция тромбообразования, устранение гипергомоцистеинемии, терапия ПМС имеют непосредственное отношение к профилактике или, по крайней мере, к ослаблению, побочных эффектов эстрогенсодержащих препаратов.
Участие витамина В6 и магния в осуществлении биологических эффектов эстрогенов
Активные формы витамина В6 и ионы магния необходимы для осуществления, по крайней мере, некоторых из физиологических эффектов эстрогенов. Дело в том, что среди сотен генов, экспрессия которых изменяется при активации эстрогеновых рецепторов, присутствуют гены, кодирующие магнийзависимые и витамин-В6-зависимые белки. Активность этих белков резко снижается на фоне дефицита магния/пиридоксина, так что снижается и соответствующий физиологический эффект эстрогенов.
В настоящей работе предпринята попытка смоделировать эффекты упомянутого ранее рецепторопосредованного механизма действия эстрогенов. Моделирование проводилось посредством полногеномного анализа сайтов связывания стероидных рецепторов. Для анализа использовался разработанный авторами интегральный метод аннотации генов и нуклеотидных полиморфизмов [59]. Этот метод анализирует возможное функциональное значение каждого участка гена и находящихся в нем полиморфизмов через систематический перебор фундаментальных молекулярно-биологических механизмов (транскрипция, трансляция, стабильность ДНК, функции белков и т.д.).
По результатам проведенного полногеномного анализа было установлено, что активация эстрогеновых рецепторов может приводить к модулированию экспрессии более 600 генов из генома человека. Среди этих генов, по крайней мере, 4 гена кодируют В6-зависимые белки (см. табл. 1), а 11 генов – магнийзависимые белки (см. табл. 2).
Таблица 1. Пиридоксинзависимые белки, транскрипция генов которых регулируется рецептором эстрогенов. Локус, расположение гена на хромосоме с использованием цитогенетической номенклатуры.
| Ген | Локус | Белок | Функция |
|---|
| GAD2 | 10p12 | Глутамат декарбоксилаза | Синтез ГАМК. Кофактор – пиридоксальфосфат | | GCAT | 22q13 | Аминокетобутират КоА-лигаза | Деградация треонина. Высокие уровни в печени и головном мозге | | STAT2 | 12q13 | Сигнальный активатор транскрипции 2 | Передача внутриклеточного сигнала от рецепторов интерферонов | | STAT5A | 17q21 | Сигнальный активатор транскрипции 5А | Передача сигнала от рецепторов факторов роста, в т.ч. факторов роста фибробластов, пролактина, играет роль в процессе гематопоэза и росте меланобластов |
Таблица 2. Магнийсвязывающие белки, транскрипция генов которых регулируется рецептором эстрогенов. Локус, расположение гена на хромосоме с использованием цитогенетической номенклатуры.
| Ген | Локус | Белок | Функция |
|---|
| ADCY9 | 16p13 | Аденилатциклаза 9 | Универсальный регулятор цАМФ-зависимой передачи сигнала от адренергических рецепторов, высокие уровни в щитовидной железе | | ATP10D | 4p12 | АТФаза VD | Транспорт фосфолипидов внутрь клетки | | ATP1A1 | 1p13 | Na/K-канал (АТФаза) | Создает электрохимический градиент для транспорта различных нутриентов | | CHEK2 | 22q12 | Киназа Chk2 | Остановка цикла деления клетки, активация ремонта ДНК, регуляция апоптоза | | ERN1 | 17q23 | Эндорибонуклеиназа 1 | Сенсор неполноценно свернутых белков, регулятор апоптоза | | INPP1 | 2q32 | Инозитол полифосфат фосфатаза 1 | Регулировка иммунитета, отклика клетки на нейротрансмиттеры. Возможный таргетный белок лития | | NEK11 | 3q22 | Киназа NEK11 | Ремонт ДНК, регуляция апоптоза | | NME3 | 16p13 | Нуклеозид дифосфат киназа 3 | Гемопоез, торможение дифференцировки гранулоцитов, регулирование апоптоза | | PDE8A | 15q25 | Фосфодиэстераза 8А | Сигнальные пути активации Т-лимфоцитов | | PFKM | 12q13 | Фосфофруктокиназа | Гликолиз, энергетический метаболизм | | PPA1 | 10q22 | Пирофосфатаза 1 | Окисление липидов, формирование кости |
Как видно из таблицы 1, В6-зависимые белки, транскрипция генов которых активируется эстрогенами, вовлечены в метаболизм нейротрансмиттеров (ген GAD2, синтез гамма-аминомаслянной кислоты, ГАМК, см. рис. 4), аминокислотный метаболизм (ген GCAT, деградация треонина), иммунитет (ген STAT2, передача сигнала от интерферон-рецепторов) и в процессы роста тканей (ген STAT5A, передача сигнала от рецепторов факторов роста). Использование эстрогеновых препаратов и низкий уровень витамина B6 связаны с повышением провоспалительных реакций [21], что, потенциально, может быть обусловлено нарушением активности сигнальных каскадов с участием STAT2. В эксперименте прием добавок пиридоксаля снижает пролиферацию клеток и синтез ДНК в линиях клеток эстрогензависимой карциномы молочной железы [17] – эффект, который может быть связан с активностью В6-зависимого сигнального белка STAT5A.
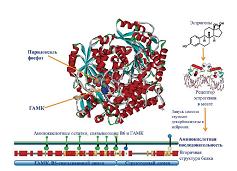 | Рисунок 4: Экспрессия гена GAD2 активируется эстрогенами, образующийся В6-зависимый белок глутаматдекарбоксилаза необходим для синтеза «тормозящего» нейротрансмиттера гамма-аминомаслянной кислоты (ГАМК). |
Кроме того, в экспериментальных и клинических исследованиях было показано, что изменение внутриклеточной концентрации пиридоксаль-5-фосфата (П5Ф), основной биологически активной формы витамина В6, оказывает модулирующее воздействие на экспрессию генов, регулируемых стероидными рецепторами. Повышение внутриклеточного уровня П5Ф приводит к снижению транскрипционного ответа на активацию глюкокортикоидных, прогестеронового, андрогенового и эстрогеновых рецепторов, а дефицит витамина В6 в клетках – к повышенной чувствительности клеток к стероидным гормонам вследствие нарушения функциональных взаимодействий между рецепторами стероидных гормонов и внутриядерным фактором транскрипции NF1 [60]. Повышенная чувствительность клеток к стероидам является существенным элементом возникновения и интенсивности проявления побочных эффектов эстрогенсодержащих препаратов и связанных с ними осложнений.
Проведенный полногеномный анализ возможных эффектов эстрогенов показал, что активируемые эстрогенами магнийзависимые белки выполняют широкий спектр физиологических ролей (см. табл. 2). Так, магний-зависимые белки могут усиливать влияние эстрогенов на метаболизм нейротрансмиттеров (ген ADCY9, участвующий в передаче сигнала адренергических рецепторов; ген INPP1 – регулировка отклика нейронов на различные нейротрансмиттеры), энергетический метаболизм (ген PFKM – гликолиз; ген PPA1 – окисление липидов, ген ATP10D – транспорт фосфолипидов; ген ATP1A1 – транспорт различных нутриентов) и выживание различных видов клеток/регуляция апоптоза (гены CHEK2, NEK11, ERN1, NME3, PDE8A). Заметим, что фермент инозитол полифосфат фосфатаза 1 (ген INPP1) является одним из вероятных медиаторов осуществления биологических эффектов другого микроэлемента – лития, прием препаратов которого способствует накоплению магния в тканях организма [33].
В эксперименте уровни магния положительно влияют на осуществление биологических функций эстрогенов. В частности, взаимодействия рецептора эстрогена регулирующими активность данного рецептора белками «ER-связывающими факторами» (ERBF) регулируются ионами магния. Белки ERBF оказывают ингибирующий эффект на транслокацию рецепторов эстрогенов внутрь ядра. Ион магния в 10 раз ослабляет взаимодействия рецепторов эстрогена с белками ERBF, устраняя ингибирующие эффекты ERBF на транспорт комплексов эстроген-рецепторов внутрь ядра клетки и тем самым способствуя осуществлению физиологических эффектов эстрогенов [23].
Негативные эффекты эстрогенсодержащих препаратов на баланс витамина В6 в организме
Таким образом, и витамин В6, и магний необходимы для осуществления физиологических эффектов эстрогенов, так что дефицит этих микронутриентов будет приводить к искажению физиологического отклика клеток организма на стимуляцию эстрогенами. Следует отметить, что прием эстроген-содержащих препаратов внутрь существенно снижает обеспеченность организма витамином В6 и магнием.
Например, в исследовании группы 219 здоровых женщин средние уровни пиридоксаль фосфата плазмы (ПФП) были значительно ниже у использующих ОК (24 нмоль/л) по сравнению с тем участницами, которые не использовали противозачаточных средств (33 нмоль/л, р = 0,029) [39].
Крупномасштабное популяционное исследование «Национальное обследование здоровья и питания, 2003-2004» (NHANES, National Health and Nutrition Examination Survey, 2003-2004) включало 6165 участников и показало, что уровень пиридоксаль-5-фосфата плазмы достоверно зависит от использования эстрогенсодержащих ОК. У большинства принимавших ОК пациенток уровни ПФП были ниже минимальной нормы (т.е. <20 нмоль/л). Группу риска дефицита витамина образовали участники с диетарным потреблением витамина B6 менее 2 мг/сут. (менее 3 мг/сут. у курильщиков), пожилые и, прежде всего, участницы, использующие или использовавшие пероральные контрацептивы. Диетарное потребление витамина В6 в количествах от 3 до 4,9 мг/сут., по сравнению с потреблением в <2 мг/сут., было связано со значимым протективным эффектом от низких уровней ПФП, даже при использовании противозачаточных эстрогенсодержащих средств [43] (см. рис. 5).
![Рисунок 5: Корреляция между уровнями пиридоксаль-5-фосфата плазмы (ПФП) и оценкой диетарного потребления витамина В6 по опроснику диеты NHANES (n=6165). Точки обозначают среднеквадратичные значения для 32 изученных категорий пациентов, каждая из которых включала 3,2% (n=200) участников [43].](http://gyn.su/img/O_2013_3-g5s.JPG) | Рисунок 5: Корреляция между уровнями пиридоксаль-5-фосфата плазмы (ПФП) и оценкой диетарного потребления витамина В6 по опроснику диеты NHANES (n=6165). Точки обозначают среднеквадратичные значения для 32 изученных категорий пациентов, каждая из которых включала 3,2% (n=200) участников [43]. |
Снижение уровня активных форм витамина В6 при активации эстрогеновых рецепторов может быть связано с уменьшением поглощения В6 из пищи, повышением катаболизма активных форм витамина, нарушениями фосфорилирования витамеров B6, нарушениями метаболизма триптофана [52], перераспределением ПФП между внеклеточным и внутриклеточным пространством, усилением биотрансформации ПФП в другой витамер – пиридоксаль. Заметим, что нарушения метаболизма триптофана можно предполагать у пациенток с определенными пищевыми предпочтениями (шоколад, сыр).
Важно отметить, что эстрогены влияют на ряд поведенческих функций, так как рецепторы эстрогенов модулируют различные нейротрансмиттерные и нейропептидные системы, стимулируя возникновение тревожно-депрессивных симптомов [28]. Побочные эффекты комбинированных оральных контрацептивов, связанные с влиянием на настроение, затрагивают 4-10% пациенток [49], поэтому весьма перспективно использование препаратов пиридоксина в терапии гиперэстрогеновых состояний и, в частности, предменструального синдрома (ПМС). Как известно, ПМС связан с усиленными потерями магния организмом [57] и клиника ПМС существенно отягощается на фоне дефицита витамина В6, магния и, естественно, избытка эстрогенов.
Рандомизированное двойное слепое исследование группы 68 пациенток с ПМС показало, что, по сравнению с плацебо, прием 50 мг/сут. пиридоксина в течение 3 мес. приводил к значительному снижению выраженности симптомов ПМС (в среднем на 57%, р=0,001). В частности, эмоциональные симптомы снизились на 69% (P=0,05), соматические – на 52% (P=0,05). С другой стороны, прием плацебо приводил к повышению совокупного уровня выраженности симптомов на 37%. Таким образом, пиридоксин облегчает симптоматику ПМС, возникающую вследствие повышенных уровней эстрогена во время лютеальной фазы цикла [18] и связанных с этим потерь активных форм витамина В6 организмом.
Взаимосвязь эстрогенов с гомеостазом магния: фундаментальные исследования
Эстроген считается своего рода «магнезиотропным» гормоном, так как клинические исследования указали на выраженную корреляцию между использованием эстрогенсодержащих средств для ЗГТ у женщин в постменопаузе и уровнями магния в моче [41-44]. Фундаментальные исследования показали, что физиологический уровень эстрогенов обеспечивает регуляцию уровней экспрессии одного из основных транспортных каналов магния – TRPM6.
Mg-транспортирующий канал TRPM6 (переходный рецепторный потенциал меластатина, подтип 6) преимущественно экспрессируется в дистальных извитых канальцах (ДИК), этом кратчайшем сегменте нефрона. Выраженная экспрессия ряда транспортных белков, таких как NaCl-котранспортер (ген NCC) и эпителиальный Mg2+-канал TRPM6 на поверхности канальцев делает их основным местом активной тран склеточной реабсорбции Mg2+ с мочой. Нарушения
регуляции TRPM6-канала связаны с избыточной потерей магния почками [64].
Mg-транспортирующий канал TRPM6 – неотъемлемый элемент гомеостаза магния в организме. Мутации гена TRPM6 связаны с врожденной гипомагниемией со вторичной гипокальциемией. Активность канала TRPM6 является одним из важных факторов, воздействующих на баланс магния в организме [9]. Фундаментальные исследования показали, что экспрессия TRPM6 регулируется рядом гормонов (эпидермальный фактор роста, эстрогены и др.), внутриклеточными концентрациями Mg2+, рН и АТФ [61] и др. (см. табл. 3).
Таблица 3. Факторы, воздействующие на экспрессию канала TRPM6 и уровни магния.
| Фактор | Влияние на TRPM6 | Влияние на гомеостаз Mg2+ |
|---|
| EGF | Повышение активности | Гипомагнезурия | | RACK1 | Повышение активности фосфорилированием α-киназного домена | Гипомагнезурия | | Ацидоз | Снижение экспрессии и активности | Гипомагнеземия | | Алкалоз | Возрастание экспрессии | Гипермагнеземия | | Эстрадиол | Возрастание экспрессии | Гипомагнезурия | | Циклоспорин | Снижение экспрессии | Гипомагнеземия | | Тиазидные диуретики | Снижение экспрессии | Гипомагнеземия |
На рисунке 6 показана регулировка гомеостаза магния эпителиальными клетками дистальных извитых канальцев – сегмента почки, где происходит активная реабсорбция Mg2+ посредством каналов TRPM6. В регуляции TRPM6 принимают участие эстрогены, кислотно-основной баланс, и такие фармацевтические препараты как такролимус и циклоспорин. Кислые значения внеклеточного рН (pH<7) способствуют повышению проницаемости TRPM6, а внутриклеточные уровни Mg2+ ингибируют активность канала. Фактор роста эпидермиса (EGF) и эстрогены действуют как магнезиотропные гормоны, стимулирующие
количество и активность каналов TRPM6.
В эксперименте было установлено, что эстрадиол увеличивает уровни экспрессии гена TRPM6 в почках, а хирургическое удаление яичников вызывает значительное сокращение экспрессии TRPM6 в почках. Кроме того, послеоперационная обработка эстрадиолом восстанавливает уровни мРНК гена TRPM6. Эти факты указывают на регулирующие роли эстрогена в транскрипции гена TRPM6 [26].
Влияние эстрогенов на активность Mg-транспортирующего канала TRPM6 может осуществляться не только за счет воздействия на транскрипцию этого гена, но и через более быстрые (минуты), не-транскрипционные пути регулирования [22,42,65]. К таковым относится, например, быстрое стимулирующее действие из 17-бета-эстрадиола на TRPM6 [63], приводящее к диссоциации регуляторного белка REA от киназного домена TRPM6, что приводит к изменению активности TRPM6 (см. рис. 6).
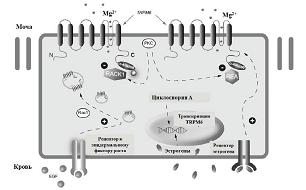 | Рисунок 6: Регулировка гомеостаза магния эпителиальными клетками дистальных извитых канальцев. |
Следует отметить, что к настоящему моменту фундаментальные исследования взаимосвязи гомеостаза магния и эстрогенов развивались однобоко и были сосредоточены, в основной массе, именно на изучении эффектов эстрогенов на активность и экспрессию канала-транспортера TRPM6. Очевидно, что повышение экспрессии этого канала эстрогенами не может объяснить вызываемые эстрогенами дефицит магния и гиперкальциемию [34] или дозозависимое снижение уровней магния в тканях мозга, печени, почек и сердца [47]. Влияние эстрогенов на канал TRPM6 также не может объяснить выраженное снижение уровней магния в крови при приеме пациентками препаратов эстрогенов [12].
Взаимосвязь эстрогенов с гомеостазом магния: клинические наблюдения
По данным многочисленных клинических исследований, эстрогены являются своего рода физиологическими антагонистами магния. Например, в контролируемом клиническом исследовании сравнение группы здоровых женщин детородного возраста с группой женщин в постменопаузе показало, что уровни Mg2+ обратно пропорциональны уровням эстрогена в сыворотке [44]: более высокие уровни эстрогена в сыворотки соответствовали более низким уровням магния (см. рис. 7).
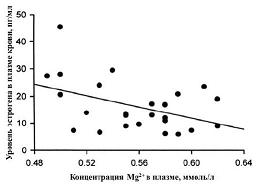 | Рисунок 7: Соотношение между уровнями эстрогена (пг/мл) и магния (ммоль/л) в сыворотке крови. |
Обратные корреляции между содержанием магния и эстрогенов в крови подтверждаются результатами клинических испытаний эстрогеновых препаратов. В группе 50 женщин, принимавших ОК, отмечено значительное снижение сывороточных уровней кальция, магния и фосфора, в то время как инъекционные контрацептивы способствовали увеличению уровней этих минералов [27]. Данный эффект связан, по всей видимости, с упоминаемым ранее нежелательным воздействием эстрогенов (при приеме внутрь) на печеночный метаболизм и с нарушениями экспрессии сотен генов, которые, приводят, в частности, к потерям организмом пиридоксина и магния.
Влияние пероральных контрацептивов на уровни магния в сыворотке оценивались в группе 32 женщин (средний возраст 24,2 года), посещающих клиники планирования семьи. Таблетки, содержащие 0,03 мг этинилэстрадиола и 0,15 мг левоноргестрела, принимались в течение 6 мес. За это время прием противозачаточных таблеток способствовал снижению уровня магния в плазме, в среднем, от 0,82 ммоль/л до 0,61 ммоль/л [11]. Последнее соответствует глубокому дефициту магния – по данным крупномасштабных исследований и современным нормам, принятым в РФ, нижней границей нормы содержания магния в плазме крови является уровень в 0,85 ммоль/л, норма – 0,85-1,15 ммоль/л.
Влияние ОК на уровень магния в крови было изучено в группе 224 женщин, посещающих послеродовую клинику планирования семьи. Из них 44 не было дано никакой терапии, 87 были оснащены петлями Lippes, 28 принимали «Ovral» и 65 принимали «Norlestrin Fe» в течение 6-9 мес. Прием ОК способствовал значительному снижению уровней магния в ПК по сравнению с контролем (р<0,001). При этом эффект зависел от дозы эстрогена [45].
Существует несколько вероятных объяснений такого «антимагниевого эффекта» эстрогеновых препаратов. Во-первых, пероральный прием эстрогенов может нарушать абсорбцию магния в кишечнике. Абсорбция магния в основном происходит в тонком кишечнике, при этом главным образом выделяют 12-перстную кишку. Абсорбция магния в кишечнике составляет ~ 20-60% от общего количества элемента, поступившего с пищей. Усиливают всасывание магния в пищеварительном тракте витамины В6 и В1, а нарушают эстрогены и ряд других ятрогенных факторов [57].
Во-вторых, уровень магния может снижаться вследствие повышения эстрогенами активности паращитовидной железы. Как известно, паращитовидная железа поддерживает уровень кальция в крови в диапазоне, обеспечивающем физиологическое функционирование организма. Когда уровень кальция в крови падает ниже определенного уровня, Ca-сенсорные рецепторы (CaSR) паращитовидной железы активируются и железа начинает секретировать паратгормон (ПТГ) в кровь. Паратгормон стимулирует остеокласты, в результате происходит перемещение кальция из костного депо для поддержки диапазона нормальных концентраций кальция в крови [31].
Взаимная регуляция уровня ПТГ и магния организована достаточно сложно. С одной стороны, ПТГ регулирует гомеостаз магния путем модуляции почечной реабсорбции магния в дистальных извитых канальцев [62]. С другой стороны, дотации магния подавляют резорбцию кости, ингибируя секрецию ПТГ, даже при высоком содержании фосфора в диете [40]. В клинических исследованиях установлена обратная корреляция между уровнем сывороточного ПТГ и уровнем сывороточного магния [14]. Гиперпаратироидизм способствует истощению депо магния в организме [46,48,56].
В третьих, долговременный прием эстрогеновых препаратов приводит к дефициту в организме важного синергиста магния – витамина В6. Как было отмечено ранее, дефицит В6 соответствует повышению склонности пациенток к стрессовым состояниям, дисфории, депрессии, эмоциональной неустойчивости, что приводит к усиленной потери магния в состоянии стресса. Дефицит магния будет способствовать дальнейшему ухудшению самочувствия, так как низкий уровень магния в крови вызывает некоторые виды головной боли, включая мигрень (мигрень при ПМС, в частности), головной боли напряжения, кластерные и посттравматические головные боли, головной боли при гемодиализе [25].
Изменение уровня магния и других микронутриентов с фазами менструального цикла
При рассмотрении взаимодействия между уровнями эстрогенов, магния и активных форм витамина В6 нельзя не упомянуть цикличность изменения уровней этих микронутриентов по фазам менструального цикла. Гормональные изменения, происходящие во время менструального цикла, влияют не только на созревание яйцеклетки, эндометрий и вагинальный кислотно-щелочной баланс, на и на такие физиологические и биохимические показатели состояния тканей организма, как уровень кальция, магния, фосфора в сыворотке в разные фазы менструального цикла. Например, эстрогены вызывают гиперкальциемию посредством воздействия на паращитовидную железу [32], а дефициты эстрогенов, наоборот, способствуют значительным потерям кальция из костной ткани [15].
Известно, что для прогестероновой (лютеальной) фазы цикла характерно увеличение базального метаболизма и повышение потребности в углеводах, магнии, кальции и витаминах, необходимых для синтеза коферментов энергетического метаболизма. К данным витаминам относятся, прежде всего, такие витамины группы В, как рибофлавин (В2), миоинозитол (В8), ниацин (РР), пантотеновая кислота (В5) и пиридоксин (В6) [16]. Соответственно, уровни этих и других микронутриентов могут существенно отличаться по фазам менструального цикла.
В исследовании 50 здоровых женщин в возрастной группе 17-28 лет были установлены достоверные колебания уровней кальция, фосфора и магния по фазам менструального цикла. Для каждой пациентки была изучена детальная картина менструального цикла за несколько лет и установлены индивидуальные границы фаз цикла (менструальная, фолликулярная и лютеальная фазы). Участницы, страдающие от нервно-психических расстройств или любой другой болезни, влияющей на менструальный цикл, не были включены в исследование [19].
В результате исследования было установлено, что уровни кальция сыворотки варьировали от 8,3 до 10,5 мг/дл (9,52±0,55 мг/дл) в менструальную фазу и от 9,3 до 11,0 мг/дл (10,08±0,48 мг/дл) в фолликулярную фазу. Во время лютеальной фазы сывороточные уровни кальция варьировали от 8,4 до 10,6 мг/дл (9,29±0,52 мг/дл). Сывороточные уровни магния варьировали от 1,5 до 2,7 мг/дл (2,01±0,26 мг/дл) в менструальную, от 1,3 до 2,5 мг/дл (1,76±0,3 мг/дл) в фолликулярную и от 1,7 до 2,8 мг/дл (2,18±0,27 мг/дл) и лютеальную фазы.
Хотя ни одно из значений не выходило за пределы диапазона нормы, сывороточные уровни магния были значительно ниже именно в фолликулярную (т.е. эстрогеновую) фазу, чем в две другие фазы. Уровень кальция был самым высоким в фолликулярной фазе, в то время как уровень сывороточного магния был самым низким в фолликулярной фазе; уровень неорганического фосфора в сыворотке был высоким в менструальную фазу [19]. Снижение сывороточных уровней магния в фолликулярной фазе на 12% по сравнению с менструальной фазой цикла и увеличение на 20% (по сравнению с фолликулярной) в лютеальную фазу может быть обусловлено стимулирующим воздействием повышенных уровней эстрогенов на паращитовидную железу.
Использование препаратов магния и пиридоксина в терапии состояний, связанных с дисбалансом эстрогенов
Заметим, что данное направление исследования представлено, в основном, использованием препаратов магния и пиридоксина в терапии предменструального синдрома. Коррекция дефицита магния у женщин с ПМС может потенцировать терапию другими препаратами, направленными на лечение ПМС (гипотиазид, ременс, грандаксин, препараты, содержащие экстракт Agnus Castus, низкодозированные комбинированные оральные контрацептивы (КОК), такие как Мастодинон и Циклодинон, микро- и низкодозированные гормональные препараты, такие как Новаринг, Три-Мерси, Джес, Ярина и др.), оптимизируя фармакодинамический и фармакокинетический ответы на лекарственное воздействие [6]. 12 двойных плацебо-контролируемых исследований доказали, что высокая доза КОК приводит к резкому падению концентраций витамина В6 в течение первых 1-3 мес. применения КОК. 25 двойныхслепых плацебо-контролируемых исследований показали эффективность использования высоких доз витамина В6 (до 100 мг/сут.) для лечения ПМС, сочетающегося с депрессиями, мигренозной головной болью, гиперчувствительностью и нагрубанием груди [30].
Апробирована т.н. пульс-терапия магнием и пиридоксином (препараты Магне В6 и Магне B6 Форте) при ПМС. Этот вид терапии основан на вышеупомянутом биоритме магния, и прием препарата производится только во вторую фазу цикла, перед менструацией. Клинические наблюдения за 107 женщинами с ПМС в возрасте 14-45 лет показали наличие нервно-психической формы ПМС – диагностирована у 39% женщин; отечная форма ПМС диагностирована у 44% женщин [2]. 36 из 107 (33%) обследованных женщин с ПМС получили терапию препаратом Магне В6 (15 мг солей/кг веса, 2 ампулы/сут.) в режиме пульс-терапии в течение двух менструальных циклов. Прием лактата и пидолата магния в комбинации с пиридоксином приводил не только к повышению уровня магния в сыворотке крови (уровень магния в сыворотке в середине цикла вошел в нижний диапазон нормы – 0,85±0,07 ммоль/л), но и к отчетливой положительной клинической динамике течения ПМС. После лечения женщины не предъявляли жалоб на приступы тахикардии и зябкость, судороги и чувство онемения конечностей, что связано в первую очередь с восстановлением магниевого баланса. Существенно редуцировалось проявление такого важного клинического симптома, как отеки лица и нижних конечностей, связанные с менструацией. Аллергических реакций на препарат не отмечалось.
Отметим, что очевидно парадоксальные попытки использовать различные эстроген-содержащие гормональные препараты в терапии ПМС приводят к значительным потерям магния. До 40% женщин в первые месяцы приема эстрогенсодержащих ОК развивается не только дефицит магния, но и дефицит пиридоксина. Эстрогены проявляют антагонизм по отношению к пиридоксину и на их фоне потребность в витаминах группы В (в т.ч. и в витамине В6) увеличивается. Восстановление уровня магния и пиридоксина (препараты Магне В6, Магне Б6 Форте) у женщин с дефицитом магния вследствие длительного (3-6 мес.) приема контрацептивов значительно повышает качество жизни пациенток [5].
Исследование 48 пациенток с предменструальным синдромом [4] показало значительное уменьшение клинических проявлений ПМС после курса терапии Магне В6. Основными жалобами пациенток были раздражительность (89%), масталгия и мастодиния (83%), депрессия (47%), которые значительно уменьшились после курса терапии (см. рис. 8).
![Рисунок 8: Частота симптомов ПМС и терапия Магне В6 [2].](http://gyn.su/img/O_2013_3-g8s.JPG) | Рисунок 8: Частота симптомов ПМС и терапия Магне В6 [2]. |
Заключение
Прием препаратов эстрогенов внутрь, даже т.н. «низкодозированных», связан с такими негативными эффектами, как повышенный риск тромбоэмболических заболеваний, ишемический инсульт и инфаркт миокарда, смертность от осложнений со стороны сердечно-сосудистой системы и ряда раковых заболеваний. Результаты проведенного систематического анализа фундаментальных и клинических исследований показали, что побочные эффекты эстрогеновых препаратов могут быть существенно снижены за счет сочетанного приема магния и пиридоксина. Оба микронутриента характеризуются доказанным положительным воздействием на здоровье человека и снижают, в частности, риск ишемического инсульта, инфаркта миокарда и сердечно-сосудистой смертности (см. рис. 9).
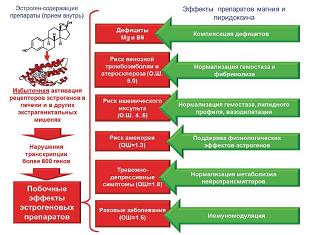 | Рисунок 9: Сочетанный прием магния и пиридоксина позволяет снизить проявления побочных эффектов пероральных эстрогеновых препаратов. |
Эстрогены способствуют усиленному выведению магния и пиридоксина из организма. Поэтому при одном и том же уровне пиридоксина в диете дефицит пиридоксина разовьется быстрее у «гиперэстрогеновых» пациенток. Прием пероральных эстрогенов крайне усугубляет микронутриентные дефициты, особенно при приеме в течение длительных курсов. Следует отметить, что длительность обычного курса весьма сильно-действующими средствами – эстрогенами – просто поражает – от 3-6 мес. до нескольких лет. В то же время практически не существует детальных исследований побочных эффектов столь сильнодействующих фармакологических препаратов на состояние биохимических показателей крови, физикальное и психическое состояние пациенток регулярно, в течение всего курса приема. Принято считать, что сильнодействующие эстрогены являются «безопасными», а витаминно-минеральные препараты, являющиеся фундаментальной основой любой эффективной и безопасной терапии, «бесполезными» или даже «вредными», и срок их приема зачастую ограничен двумя месяцами.
Цитрат магния (Магне B6 форте) является наиболее оптимальным препаратом для восполнения дефицита магния по нескольким причинам. Несомненным эффектом обладает эндотелиопротекторное свойство магния, однако цитратный анион в составе цитрата магния также обладает антиоксидантным действием. Цикл лимонной кислоты (цикл Кребса) – центральный компонент метаболического пути преобразования углеводов, жиров и белков в углекислый газ и воду для генерации химической энергии в виде АТФ [1].
При этом известно, что пиридоксин повышает всасывание магния в желудочно-кишечном тракте. Дозы перорального применения цитрата магния (Магне В6 форте) – 1 таблетка 3-4 раза в день [3].
Заметим также, что вопрос о перераспределении магния между различными тканями организма во время приема эстрогенов внутрь остается практически не исследованным. В частности, производятся отдельные измерения уровня магния в моче (однократно, в начале и в конце исследования), но не в плазме крови и не в эритроцитах. Такого рода разрозненные исследования приводят к парадоксальным выводам: снижение выведения магния с мочой при использовании эстрогенового препарата (т.е., казалось бы, снижение дефицита магния) наблюдается на фоне снижения уровней магния в крови (т.е. дефицит магния). Очевидно, что для получения более целостной картины перераспределения магния необходимы регулярные (по меньшей мере, 1 раз/мес.) измерения уровней магния во всех доступных биосубстратах (плазма крови, эритроциты, лимфоциты, моча, волосы) в течение всего курса приема эстрогенсодержащих пре паратов.
Литература:
1. Громова О.А. Магний и пиридоксин. Основы знаний. М. 2006; с. 43.
2. Громова О.А. Бухарина Е.В. Галицкая С.А. Гришина T.P., Волков А.Ю., Мокроусов А.А. Коррекция дефицита магния у женщин с предменструальным синдромом. Акушерство и гинекология. 2003; 5: 48-52.
3. Инструкция по медицинскому применению Магне В6 форте.
4. Лебедев В.А. с соавт. Вопросы гинекологии, акушерства и перинатологии. 2008; 7 (1): 20-25.
5. Назарова Н.М., Прилепская В.Н., Межевитинова Е.А. Профилактика побочных реакций при гормональной контрацепции препаратом Магне-В6. Акушерство и гинекология.2003; 4: 52-54.
6. Руководство по контрацепции. Под ред. B.H.Прилепской. 2-е изд. M. 2010.
7. Торшин И.Ю., Громова О.А. 25 мгновений молекулярной фармакологии. Иваново;
2012.
8. Торшин И.Ю., Громова О.А., Серов В.Н., Керимкулова Н.В., Лиманова О.А., Никифорова Н.В. Мировой опыт использования пиридоксина: экспериментальная и клиническая база применения в акушерско-гинекологической практике. Гинекология. 2013; 1: 63-67.
9. Alexander R.T., Hoenderop J.G., Bindels R.J. Molecular determinants of magnesium homeostasis: insights from human disease. J. Am. Soc. Nephrol. 2008; 19 (8): 1451-8 doi.
10. Bercovici J.P., Mabin D. Vitamin B 6 deficiency following the taking of estrogens. Nouv Presse Med. 1977; 6 (27): 2439.
11. Blum M., Kitai E., Ariel Y., Schnierer M., Bograd H. Oral contraceptive lowers serum magnesium. Harefuah. 1991; 121 (10): 363-364.
12. Bureau I., Anderson R.A., Arnaud J., Raysiguier Y., Favier A.E., Roussel A.M. Trace mineral status in post menopausal women: impact of hormonal replacement therapy. J. Trace Elem. Med. Biol. 2002; 16 (1): 9-13.
13. Cabodi S., Moro L., Baj G., Smeriglio M., Di Stefano P., Gippone S. et al. p130Cas interacts with estrogen receptor alpha and modulates non-genomic estrogen signaling in breast cancer cells. J. Cell. Sci. 2004; 117: 1603-11.
14. Cho M.S., Lee K.S., Lee Y.K. Relationship between the serum parathyroid hormone and magnesium levels in continuous ambulatory peritoneal dialysis (CAPD) patients using lowmagnesium peritoneal dialysate. Korean. J. Intern. Med. 2002; 17 (2): 114-121.
15. Christiansen C., Riss B.J. Five years with continuous combined estrogen progesterone therapy: Effect on calcium metabolism, lipoproteins and bleeding pattern. Br. J. Obstet. Gynaecol. 1990; 97: 1087-92.
16. Czaja J.A. Ovarian influences on primate food intake. Physics. Behav. 1978; 21: 923.
17. Davis B.A., Cowing B.E. Pyridoxal supplementation reduces cell proliferation and DNA synthesis in estrogen-dependent and -independent mammary carcinoma cell lines. Nutr. Cancer. 2000; 38 (2): 281-286.
18. Doll H., Brown S., Thurston A., Vessey M. Pyridoxine (vitamin B6) and the premenstrual syndrome: a randomized crossover trial. J. R. Coll. Gen. Pract. 1989; 39 (326): 364-368.
19. Dullo P., Vedi N. Changes in serum calcium, magnesium and inorganic phosphorus levels during different phases of the menstrual cycle. J. Hum. Reprod. Sci. 2008; 1 (2): 77-80.
20. European Food Safety Authority, EFSA, 2006. Tolerable upper intake levels for vitamins and minerals. www.efsa.europa.eu/en/ndatopics/docs/ndatolerableuil.pdf.
21. Friso S., Jacques P.F., Wilson P.W., Rosenberg I.H., Selhub J. Low circulating vitamin B(6) is associated with elevation of the inflammation marker C-reactive protein independently of plasma homocysteine levels. Circulation. 2001; 103: 2788-91.
22. Fu X.D., Cui Y.H., Lin G.P., Wang T.H. Nongenomic effects of 17beta-estradiol in activation of the ERK1/ERK2 pathway induces cell proliferation through upregulation of cyclin D1 expression in bovine artery endothelial cells. Gynecol. Endocrinol. 2007; 23: 131-7.
23. Fukai F., Murayama A. Association and dissociation of estrogen receptor with estrogen receptor-binding factors is regulated by Mg2+. J. Biochem. 1984 Apr; 95 (4): 1227-30.
24. Gibson R.S. «Assessment of vitamin B6 status.» Principles of Nutritional Assessment (2nd ed.). New York: Oxford University Press. 2005; 575-594.
25. Goksel B.K., Torun D., Karaca S., Karatas M., Tan M., Sezgin N., Benli S., Sezer S., Ozdemir N. Is low blood magnesium level associated with hemodialysis headache? Headache. 2006; 46 (1): 40-45.
26. Groenestege W.M., Hoenderop J.G., van den Heuvel L., Knoers N., Bindels R.J. The epithelial Mg2+ channel transient receptor potential melastatin 6 is regulated by dietary Mg2+ content and estrogens. J. Am. Soc. Nephrol. 2006; 17 (4): 1035-43.
27. Hameed A., Majeed T., Rauf S. Effect of oral and injectable contraceptives on serum calcium, magnesium and phosphorus in women. J. Ayub. Med. Coll. Abbottabad. 2001; 13 (3): 24-25.
28. Handa R.J., Mani S.K., Uht R.M. Estrogen receptors and the regulation of neural stress responses. Neuroendocrinology. 2012; 96 (2): 111-8 doi.
29. Heiss G., Wallace R., Anderson G.L., Aragaki A., Beresford S.A., Brzyski R., Chlebowski R.T., Gass M., LaCroix A., Manson J.E., Prentice R.L., Rossouw J., Stefanick M.L. Health risks and benefits 3 years after stopping randomized treatment with estrogen and progestin. JAMA. 2008; 299 (9): 1036-1045.
30. Higdon J. En Evidence-Based Approach to Vitamins and minerals. New York-Stuttgart. 2005.
31. Hoorn E.J., Zietse R. Disorders of calcium and magnesium balance: a physiology-based approach. Pediatr. Nephrol. 2012.
32. Hsch A.J., Peck E.J., Clark J.H. Progesterone antagonism of estrogen receptor and estrogen induced growth. Nature. 1975; 254: 337-9.
33. Kielczykowska M., Musik I., Hordyjewska A., Boguszewska A., Lewandowska A., Pasternak K. Oral administration of lithium increases tissue magnesium contents but not plasma magnesium level in rats. Pharmacol. Rep. 2007; 59 (3): 291-295.
34. Koh E.T., Owen W.L., Om A.S. Exogenous oestrogen affects calcium metabolism differently from exogenous testosterone in ovariectomized or orchiectomized rats fed a high fructose diet severely deficient in magnesium. Magnes. Res. 1996; 9 (1): 23-31.
35. Leklem J.E. Vitamin B-6: a status report. J. Nutr. 1990; 120: 1503-1507.
36. Levin E.R. Cellular functions of plasma membrane estrogen receptors. Steroids. 2002; 67: 471-5.
37. Lidegaard O. Oral contraception and risk of a cerebral thromboembolic attack: results of a case-control study. BMJ. 1993; 306 (6883): 956-963.
38. Lui A., Lumeng L., Aronoff G.R., Li T.K. Relationship between body store of vitamin B6 and plasma pyridoxal-P clearance: metabolic balance studies in humans. J. Lab. Clin. Med. 1985; 106 (5): 491-497.
39. Lussana F., Zighetti M.L., Bucciarelli P., Cugno M., Cattaneo M. Blood levels of homocysteine, folate, vitamin B6 and B12 in women using oral contraceptives compared to non-users. Thromb Res. 2003; 112 (1-2): 37-41.
40. Matsuzaki H., Fuchigami M., Miwa M. Dietary magnesium supplementation suppresses bone resorption via inhibition of parathyroid hormone secretion in rats fed a highphosphorus diet. Magnes Res. 2010; 23 (3): 126-30 doi.
41. McNair P., Christiansen C., Transbol I. Effect of menopause and estrogen substitutional therapy on magnesium metabolism. Miner. Electrolyte Metab. 1984; 10: 84-7.
42. Moriarty K., Kim K.H., Bender J.R. Minireview: estrogen receptor-mediated rapid signaling. Endocrinology. 2006; 147: 5557-63.
43. Morris M.S., Picciano M.F., Jacques P.F., Selhub J. Plasma pyridoxal 5-phosphate in the US population: the National Health and Nutrition Examination Survey, 2003-2004. Am. J. Clin. Nutr. 2008; 87 (5): 1446-1454.
44. Muneyyirci-Delale O., Nacharaju V.L., Dalloul M., Altura B.M., Altura B.T. Serum ionized magnesium and calcium in women after menopause: inverse relation of estrogen with ionized magnesium. Fertil. Steril. 1999; 71 (5): 869-872.
45. Olatunbosun D.A., Adeniyi F.A., Adadevoh B.K. Effect of oral contraceptives on Serum magnesium levels. Int. J. Fertil. 1974; 19 (4): 224-226.
46. Pandya A.K., Chandwani S., Das T.K., Pandya T.K. Serum calcium, magnesium and inorganic phosphorus levels during various phases of menstrual cycle. Indian. J. Physiol. Pharmacol. 1995; 39: 411-4.
47. Pasternak K., Sztanke M., Borzecki A. Magnesium concentration in rat tissues receiving sex hormones and vitamin E. Ann. Univ. Mariae Curie Sklodowska Med. 2004; 59 (2): 114-118.
48. Pitkin R.M., Renolds W.A., William G.A., Nargis G.K. Calcium regulating hormones during the menstrual cycle. J. Clin. Endocrinol. Metabol. 1978; 47: 626-32.
49. Poromaa I.S., Segebladh B. Adverse mood symptoms with oral contraceptives. Acta Obstet. Gynecol. Scand. 2012; 91 (4): 420-7 doi.
50. Prentice R.L., Thomas D.B. On the epidemiology of oral contraceptives and disease. Adv. Cancer. Res. 1987; 49: 285-401.
51. Revankar C.M., Cimino D.F., Sklar L.A., Arterburn J.B., Prossnitz E.R. A transmembrane intracellular estrogen receptor mediates rapid cell signaling. Science. 2005; 307: 1625-30.
52. Rose D.P., Adams P.W. Oral contraceptives and tryptophan metabolism: effects of oestrogen in low dose combined with a progestagen and of a low-dose progestagen (megestrol acetate) given alone. J. Clin. Pathol. 1972; 25: 252-8.
53. Rosenberg M.J., Waugh M.S., Meehan T.E. Use and misuse of oral contraceptives: risk indicators for poor pill taking and discontinuation. Contraception. 1995; 51 (5): 283-288.
54. Schwingl P.J., Ory H.W., Visness C.M. Estimates of the risk of cardiovascular death attributable to low-dose oral contraceptives in the United States. Am. J. Obstet. Gynecol. 1999; 180 (1): 241-249.
55. Seelig M.S. Increased need for magnesium with the use of combined oestrogen and calcium for osteoporosis treatment. Magnes. Res. 1990; 3 (3): 197-215.
56. Solomon S.F., Kurere M.S., Callway D.M. Menstrual cycle and basal metabolic rate in women. Am. J. Clin. Nutr. 1982; 36: 611-6.
57. Torshin I.Y., Gromova O.A. Magnesium & Pyridoxine: Fundamental Studies & Clinical Practice. Nova Science. NY. 2009.
58. Torshin I.Yu. Bioinformatics in the postgenomic era: physiology and medicine. Nova Biomedical Books. NY. 2007.
59. Torshin I.Yu. Sensing the change from molecular genetics to personalized medicine. Nova Biomedical Books. In «Bioinformatics in the Post-Genomic Era» series NY. 2009.
60. Tully D.B., Allgood V.E., Cidlowsk
|