ФЕТОПЛАЦЕНТАРНЫЙ АНГИОГЕНЕЗ У БЕРЕМЕННЫХ С ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТЬЮ
Макаров О.В., Волкова Е.В., Лысюк Е.Ю., Копылова Ю.В. Дата публикации на сайте: 2013-11-26 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
В статье приводятся результаты собственных исследований по изучению основ фетоплацентарного ангиогенеза, причин нарушений формирования плаценты и развития плода. Обследованы 116 пациенток с плацентарной недостаточностью (ПН) и синдромом задержи роста плода (СЗРП) и 52 здоровых пациентки с физиологическим течением беременности. Определены: проангиогенный сосудистыый фактор − плацентарный фактор роста (PlGF) и антиангиогенные сосудистые факторы: растворимая фмс-подобная тирозинкиназа (sFlt-1) и растворимый эндоглин (sEng). Определен ангиогенный коэффициент – Ка, вычисляемый по формуле sFlt-1/PlGFx10. Выявлено, что плацентарная недостаточность характеризуется нарушением баланса сосудистых факторов роста, с увеличением уровня антиангиогенных сосудистых факторов и снижением уровня проангиогенного фактора. Увеличение ангиогенного коэффициента Ка характерно для утяжеления ПН и нарастания степени тяжести СЗРП.
FETOPLACENTAL ANGIOGENESIS IN PREGNANT WOMEN WITH PLACENTAL INSUFFICIENCY
Makarov O.V., Volkova E.V., Lysyuk E.Yu., Kopylova Yu.V.
Russian National Research Medical University named after N.I. Pirogov of the Ministry of Health of the Russian Federation (Moscow)
Abstract: the article presents the results of the studing of fetoplacental angiogenesis, as the reason of placenta malfunction and featus progress. The objective: the examination included 116 pregnant famale patients with placental insufficiency and growth retardation syndrome and 52 pregnant famale patients with physiological pregnancy. Results: it was determined that proangiogenic vessel factor – placental growth factor (P1GF) and angiogenic vessel factors are the soluble fms-like tyrozinkinaze (sFlt-1) and soluble endogline (sEng). There was determined angiogenic coefficient – Ka, calculated in formule sFlt-1/PlGF×10. Conclusion: it was revealed that placental insufficiency characterized falure balance of vessel growth factors, enlarged levels of angiogenic vessel factors and low levels of proangiogenic factor. For the development of placental insufficiency and enlarged stage of growth retardation syndrome the increasion of angiogenic coefficient Ka is typical.
Key words: angiogenesis, placental insufficiency, growth retardation syndrome, vessel growth factors, angiogenic coefficient Ka.
Ключевые слова: ангиогенез, плацентарная недостаточность, синдром задержки роста плода, сосудистые факторы роста, ангиогенный коэффициент.
ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава РФ, Москва
Плацентарная недостаточность (ПН) и синдром задержки роста плода (СЗРП) являются наиболее распространенными осложнениями беременности.
По данным ВОЗ, число новорожденных с задержкой роста колеблется от 6,5% в развитых странах Европы до 31,1% в Центральной Азии. В Италии распространенность СЗРП встречается в 8% случаев от общего числа родов [15]. В России этот синдром отмечается у 2,4-17% беременных [8].
Многолетние наблюдения отечественных и зарубежных исследователей за развитием детей, рожденных с СЗРП разной степени тяжести, показали, что данная патология обуславливает не только резкое увеличение перинатальной смертности, но и многочисленные морфофункциональные изменения в организме ребенка, приводящие к неблагоприятным последствиям в дальнейшей его жизни. Перенесенная тяжелая ПН может приводить к нарушениям физических и умственных способностей, а также повышенной соматической и инфекционной заболеваемости новорожденных и детей на первом году жизни, являясь в дальнейшем причиной развития таких заболеваний, как артериальная гипертензия, сахарный диабет, метаболический синдром [5,8,11].
При анализе общепринятых функциональных тестов было выявлено, что они высоко информативны только при тяжелых формах ПН и СЗРП. Диагностика ПН при ультразвуковой био- и плацентометрии составляет 55%; при кардиотокографии и допплерометрии сосудов системы «мать-плацента-плод» – 42,9%, а информативность этих тестов повышается при выраженной патологии до 87,0 и 83,3%, соответственно [1,2,7]. В структуре перинатальных потерь процент нераспознанных тяжелых случаев СЗРП до сих пор остается достаточно высоким: 20% по России и 10% в странах Европы [8,14]. Используемые методы оценки состояния плода и всей плацентарной системы в целом отражают различные аспекты ее функционирования, в связи с чем должны применяться в комплексе, с учетом того, что информативность их при различных состояниях не всегда одинакова. Параллельное использование нескольких разнонаправленных методов диагностики состояния плацентарной системы, в т.ч. лабораторных, дает возможность своевременно выявить ПН и СЗРП.
Одним из ведущих патогенетических механизмов развития ПН являются нарушения маточно-плацентарного и фетоплацентарного кровотоков, сопровождающиеся повышением вязкости крови, гиперагрегацией эритроцитов и тромбоцитов, расстройством микроциркуляции и сосудистого тонуса, недостаточностью артериального кровообращения [3].
В последние годы рядом ученых отводится ведущая роль сосудистым факторам роста, влияющим на развитие плаценты, дисбаланс которых приводит к развитию плацентарной недостаточности. Плацента обладает уникально быстрыми темпами роста, в регуляции которого принимают участие многочисленные проангиогенные и антиангиогенные факторы роста и их рецепторы [4,16]. Нормальное развитие плаценты напрямую зависит от «удачной» инвазии трофобласта, процессов васкулогенеза и ангиогенеза. Васкулогенез – образование и развитие кровеносных сосудов de novo из мезодермальных клеток-предшественников, тогда как ангиогенез – это создание новых сосудов из уже существующих сосудистых структур, которые в период беременности последовательно отражают формирование сосудистой системы зародыша и плаценты [6,9,12].
Особое значение для развития сосудистой сети плаценты и ее нормального функционирования имеют сосудистые факторы, стимулирующие пролиферацию эндотелиальных клеток и увеличивающие их жизнеспособность, такие как эндотелиальный фактор роста (VEGF), плацентарный фактор роста (PlGF), фактор роста фибробластов (bFGF). На поздних стадиях ангиогенеза макрофаги, фибробласты и гладкомышечные клетки секретируют антиангиогенные факторы, тормозящие миграцию и пролиферацию эндотелиальных клеток, не снижая их жизнеспособности.
Продукция антиангиогенных факторов является неотъемлемой частью нормального ангиогенеза. В результате «молекулярного диалога», возникающего в процессе васкуляризации, продукция ингибиторов служит сдерживающим фактором для избыточной инвазии клеток трофобласта, а также препятствием для дальнейшего развития сосудистого русла и формирования васкуляризованных участков тканей, подвергшихся патологическим изменениям. Антиангиогенные факторы характеризуются высокой специфической экспрессией на эндотелии [17]. К антиангиогенным факторам относятся VEGF-R1 (Flt-1), известный как FMS-подобная тирозинкиназа, VEGF-R2 (Flk-1, KDR), VEGF-R3 (Flt-4) и эндоглин [13]. Растворимые формы этих рецепторов способны связывать сосудистые факторы роста в циркуляции, замедляя или блокируя процессы ангиогенеза [21].
sFlt-1 представляет собой растворимую изоформу Flt-1 и является трансмембранным рецептором VEGF. Растворимый эндоглин (s-Eng) является изоформой корецептора трансформирующего фактора роста бета (TGF-бета). Так как растворимая изоформа эндоглина содержит TGF-бета-связывающий домен, он может связывать циркулирующий TGF-бета, соответственно, уменьшать его уровень в плазме крови. TGF-бета является проангиогенной молекулой, но при высоком уровне s-Eng, обладающим антиангиогенным эффектом, он утрачивает свои свойства и инактивируется. Следовательно, s-Eng играет важную роль в развитии дисфункции эндотелия и в патогенезе плацентарной недостаточности [13].
Для нормального развития и функционирования плаценты важно равновесие между различными механизмами ангиогенеза, а также баланс между процессами ангиогенеза и апоптоза, которые поддерживаются соотношением проангиогенных и антиангиогенных факторов, секретируемых как самими эндотелиальными клетками, так и клетками микроокружения.
Ряд исследователей полагают, что плацента является пусковым механизмом для возникновения повреждения эндотелиальных клеток, продуцируя антиангиогенные факторы, которые блокируют дей ствие VEGF и PlGF, что, в свою очередь, приводит к расстройству ее функций [13, 23].
По данным Romero R. (2008), возникающая при ПН гипоксия может регулировать экспрессию PlGF в плацентарной ткани, увеличивая продукцию s-Flt-1, которая может конкурентно связывать свободно циркулирующие проангиогенные факторы VEGF и PlGF и еще больше усугублять дисбаланс в сторону антиангиогенного состояния [18,19].
По данным Girardi G. et al. (2006), при развитиии плацентарного трофобласта в условиях гипоксии в кровь матери начинает поступать большое количество антиангиогенных факторов, таких как sFlt-1 и sEng. Повышенная концентрация sFlt-1 подавляет плацентарную дифференциацию цитотрофобласта, нарушает процессы инвазии, что играет непосредственную роль в патогенезе аномальной плацентации, связанной с развитием плацентарной недостаточности и нарушений роста плода [13].
Воспалительные процессы в материнском организме и циркулирующие воспалительные молекулы также могут повышать производство sFlt-1, что в итоге приводит к дисбалансу сосудистых факторов роста и неблагоприятным исходам беременностей [13]. Хотя не все факторы, вырабатываемые плацентой, ответственны за развитие эндотелиальной дисфункции, последние данные показывают, что дисбаланс про- и антиангиогенных факторов, вырабатываемых плацентой и попадающих в материнский кровоток, играют значительную роль в развитии эндотелиоза и, как следствие, в развитии плацентарной недостаточности [13, 23].
Детальное изучение основ фетоплацентарного ангиогенеза, причин нарушений формирования плаценты и развития плода является крайне актуальным, так как позволит разработать комплекс мероприятий по ранней диагностике и профилактике плацентарной недостаточности для своевременного лечения и выбора оптимальной акушерской тактики с целью снижения перинатальной заболеваемости и смертности.
Материалы и методы
В исследование включены 168 беременных: I ос новную группу составили 116 пациенток с ПН и СЗРП, II контрольную группу – 52 соматически здоровые беременные с неотягощенным акушерско-гинекологическим анамнезом и физиологическим течением беременности. Основная группа разделена на три подгруппы, в зависимости от степени тяжести СЗРП: IA подгруппу составили 44 беременных с СЗРП I степени тяжести, IБ подгруппу составили 38 беременных с СЗРП II степени и IВ подгруппу – 34 беременных с СЗРП III степени. Исследование проводили в сроке от 28 до 40 недель.
Всем беременным проведено комплексное клинико-лабораторное обследование, включающее клинический анализ крови, биохимический анализ крови, коагулограмму, общий анализ мочи. Из дополнительных методов проводилось ультразвуковая фето- и плацентометрия, допплерография маточных артерий, артерии пуповины, средне-мозговой артерии и аорты, кардиотокография. Диагноз СЗРП устанавливали при выявлении параметров фетометрии ниже 10-го перцентиля. Степень тяжести СЗРП определяли по отставанию параметров фетометрии от должного гестационного срока. При I степени тяжести СЗРП – отставание на 2 недели, при II – в пределах 3-4, при III степени – более 4 недель. Из специальных методов исследования проводили определение уровня сосудистых факторов роста с использованием наборов фирмы «R&D Systems», представляющих собой полностью готовые наборы материалов и реагентов для проведения твердофазного «сэндвич» иммуно-ферментного анализа (ИФА). Определяли сывороточное содержание сосудистых факторов роста: проангиогенный – PlGF и антиангиогенные – sFlt-1 и sEng. Получение сыворотки крови осуществляли по стандартной методике. Иммуноферментный анализ проводили в точном соответствии с рекомендациями фирмы-производителя. Беременным основной группы проводили гистологическое исследование плацент. Статистическую обработку данных производили с использованием пакета Statistica 7 (StatSoft Inc, США) и Microsoft Office Excel 2010 (Microsoft, США). Определяли средние показатели в группах для параметрических критериев, доли для непараметрических. Тестировали гипотезу об отличии средних показателей и долей в исследуемых группах. Определяли Р=95%. Сравнение средних осуществляли с помощью двустороннего t-критерия Стьюдента для независимых переменных или с помощью критерия Манна-Уитни (сравнение групп) – в случае выявления отличия распределения от нормального. Различия считали достоверными при уровне значимости p<0,05.
Результаты исследования и их обсуждение
Возраст пациенток в обследуемых группах достоверно не различался и составил в среднем в основной группе 28,8±1,1 лет (от 19 до 38 лет) и в контрольной 27,5±1,5 лет (от 20 до 32 лет).
При анализе росто-весовых показателей в исследуемых группах выявлено достоверное отличие показателей индекса массы тела у беременных основной группы по сравнению с контрольной. Достоверно меньший индекс массы тела был у беременных основной группы – 19,04±1,1 кг/м2 по сравнению с пациентками контрольной группы – 22,3±1,2 кг/м2 (p<0,05). Дефицит массы тела достоверно чаще встречался в основной группе у 29 (25%) беременных по сравнению с контрольной группой, где дефицит массы тела был выявлен лишь у 2 (3,8%) беременных (p<0,05).
У 87 (75%) беременных основной группы работа была сидячая и связана с использованием компьютера, по сравнению с 37 (71,2%) пациенток контрольной группы и достоверно не отличалась (p<0,05). Пациентки основной группы были менее социально благополучны: 37 (31,9%) беременных не состояло в браке, по сравнению с контрольной группой, где в браке не состояли только 7 (13,5%) исследуемых беременных (p<0,05). В основной группе 92 (79,3%) пациенток работали, а 24 (20,7%) были домохозяйками, по сравнению со здоровыми беременными, где 34 (65,4%) пациенток были домохозяйками. Беременные основной группы достоверно чаще имели вредные привычки, такие, как курение в 33 (28,4%) случаев, по сравнению с контрольной группой, где курили 4 (7,7%) беременных (p<0,05).
При анализе соматической заболеваемости выявлены достоверные отличия в исследуемых группах. Достоверно чаще беременные основной группы страдали заболеваниями почек по сравнению со здоровыми беременными. Хронический пиелонефрит достоверно чаще встречался у 23 (19,8%) беременных основной группы по сравнению со здоровыми беременными – 5 (9,6%) (р<0,05). Хронический цистит достоверно чаще встречался у беременных основной группы по сравнению со здоровыми беременными – у 38 (32,7%) и у 4 (7,7%) пациенток соответственно (р<0,05). Заболевания желудочно-кишечного тракта (хронический гастрит, язвенная болезнь, дискинезия желчевыводящих путей) и щитовидной железы (аутоиммунный тиреоидит, гипотиреоз) диагностировались только у пациенток основной группы: у 32 (27,6%) и 12 (10,3%) беременных соответственно.
Таким образом, анализ соматических заболеваний показал достоверно больший процент встречаемости заболеваний мочеполовой сферы, желудочно-кишечного тракта, щитовидной железы у пациенток основной группы по сравнению с беременными контрольной группы.
При анализе гинекологических заболеваний в основной группе достоверно чаще по сравнению со здоровы ми беременными диагностированы: хронический двухсторонний сальпингоофорит – у 62 (53,4%) и 7 (13,5%) пациенток, дисфункции яичников – у 12 (10,3%) и 1 (1,9%) пациенток, эктопия шейки матки – у 48 (41,4%) и 12 (23,1%) пациенток соответственно (p<0,05). Миома матки, первичное и вторичное бесплодие диагностировали только у пациенток основной группы: у 15 (12,9%), у 15 (12,9%) и у 7 (6,9%) беременных соответственно. В 10 (8,6%) случаев беременность в основной группе наступила с помощью вспомогательных репродуктивных технологий (ЭКО), тогда как в контрольной группе все беременности наступили спонтанно.
Хроническое вирусоносительство достоверно чаще диагностировали у беременных основной группы по сравнению с пациентками группы контроля: вирус простого герпеса I типа – у 97 (83,6%) и 21 (40,4%) беременных, вирус папиломы человека – у 14 (12,1%) и 2 (3,8%), цитомегаловирусная инфекция – у 79 (68,1%) и 9 (17,3%) пациенток соответственно (p<0,05).
Течение гестационного периода основной группы достоверно чаще осложнялось угрозой прерывания беременности по сравнению с группой контроля: 100 (86,2%) и 17 (32,7%) беременных соответственно (p<0,05). Анемию диагностировали у 43 (37%) пациенток по сравнению с 4 (7,6%) здоровых беременных (p<0,05).
При анализе лабораторных данных в показателях клинического, биохимического анализа крови, общего анализа мочи достоверных отличий выявлено не было.
При ультразвуковом исследовании у беременных основной группы было диагностировано: преждевременное созревание плаценты – у 78 (67,2%) пациенток, дегенеративные изменения плаценты – у 49 (42,2%) беременных, гипоплазия плаценты – у 54 (46,6%) беременных, маловодие – у 56 (48,3%) беременных. У пациенток основной группы диагностировали аномалии расположения плаценты, такие как предлежание плаценты – у 4 (3,4%) беременных, низкое или краевое ее прикрепление – у 27 (23,3%) и 13 (11,2%) пациенток соответственно (p<0,05). В контрольной группе преждевременное созревание плаценты было диагностировано у 3 (2,6%) беременных, что было достоверно ниже по сравнению с основной группой (p<0,05). Другие виды патологии плаценты и аномалии ее расположения в группе здоровых беременных выявлено не было.
Допплерометрическое исследование проводилось 110 (94,8%) пациенткам основной группы и 49 (94,2%) пациенткам группы контроля. Срок беременности на момент исследования в среднем составил 32,8±0,6 в основной группе и 33,9±1,2 недель в контрольной группе и достоверно не отличался. В IА подгруппе, IБ и IВ подгруппах основной группы срок гестации на момент исследования в среднем составил 33,1±1,1 недель, 33,5±0,9 недель и 31,8±1,5 недель соответственно и достоверно не различался. Скорость кровотока оценивали в артерии пуповины, аорте, средней мозговой артерии и маточных артериях. Средний показатель систолодиастолического отношения (СДО) в артерии пуповины был достоверно выше в основной группе по сравнению с контрольной и составил 2,98±0,21 и 1,95±0,24 соответственно (p<0,05). При сравнении подгрупп основной группы средний показатель систолодиастолического отношения в артерии пуповины достоверно не отличался и составил в IА, IБ и IВ – 2,9±0,3, 3,2±0,5 и 2,97±0,1 соответственно. Средний показатель систолодиастолического отношения в аорте был достоверно выше у пациенток основной группы (7,1±0,8) по сравнению с контрольной (4,3±0,7), при этом средний показатель СДО в аорте у пациенток IВ подгруппы был достоверно выше по сравнению с IБ и IА подгруппой и составил 8,2±2,8, 7,03±1,8 и 6,8±0,7 соответственно (p<0,05). Средние показатели СДО в средней мозговой артерии у пациенток основной и контрольной групп достоверно не различались – 4,7±0,7 и 4,9±0,8 (p<0,05). Не было выявлено достоверных различий и среди подгрупп основной группы по данному показателю. Средние показатели СДО в правой и левой маточных артериях были достоверно выше у пациенток основной группы при сравнении с контрольной и составили 2,61±0,3, 2,63±0,3 и 1,9±0,3, 2,0±0,3 соответственно (p<0,05). Критические кровотоки (нулевой и реверсный) выявлялись достоверно чаще у пациенток IВ подгруппы по сравнению с IБ подгруппой: у 24 (70,6%) беременных и 8 (21,1%) беременных, соответственно (p<0,05). В IА подгруппе и группе контроля критические кровотоки не выявлялись.
Срок родоразрешения в основной группе составил 35,8±1,42 недель и был достоверно ниже по сравнению с контрольной группой, где срок родов составил в среднем 39,4±0,9 недель. Частота преждевременных родов в основной группе составила 47 (40,5%). Все роды контрольной группы были своевременными. Обращает на себя внимание значительно больший процент операций кесарева сечения в основной группе, по сравнению с контрольной: 50 (43,1%) и 7 (13,5%) соответственно. В 34 (68%) случаев у беременных основной группы операцию кесарева сечения проводили в экстренном порядке, а в 16 (32%) случаев – в плановом порядке по сравнению с контрольной группой, где операцию кесарева сечения всем беременным выполняли в плановом порядке.
При анализе фетометрических показателей в обследуемых группах были выявлены достоверные различия. В основной группе вес новорожденных был достоверно ниже, чем в контрольной: 2190,1±176 и 3230±386 г соответственно (p<0,05). В IВ подгруппе средний вес новорожденных составил 1418,6±381,5 г и был достоверно ниже по сравнению с показателями IБ и IА подгрупп: 2111±270,3 и 2652±144 г соответственно (p<0,05). В IБ подгруппе средний вес новорожденных был достоверно ниже, чем в IА подгруппе (p<0,05). Средний рост новорожденных в основной группе был достоверно ниже, чем в контрольной группе: 44,6±1,5 и 50,7±1,4 см. В IВ подгруппе рост новорожденных в среднем составил 36,7±2,4 и был достоверно ниже, по сравнению с показателями IБ и IА подгрупп: 44,9±2,1 и 47,9±0,9 соответственно (p<0,05). В IБ подгруппе средний рост новорожденных был достоверно ниже, чем в IА подгруппе (p<0,05). У пациенток основной группы 36 (34,3%) новорожденных сразу после родоразрешения были переведены в отделение реанимации и интенсивной терапии (ОРИТ). Для дальнейшего лечения 16 (15,2%) детей были переведены в отделение реанимации №2, а 19 (18,1%) детей в детское отделение на второй этап выхаживания. Количество койко-дней, необходимых для реабилитации новорожденных основной группы, составило 24±6,2 дней, что достоверно выше по сравнению с новорожденными контрольной группы, где средний койко-день составил 4,1±0,9 дня (p<0,05). Все дети пациенток контрольной группы были выписаны домой в удовлетворительном состоянии.
При анализе данных гистологического исследования плацент у пациенток основной группы выявлено: гипоплазия плаценты – в 42 (36,2%) случаев, диссоциированное развитие ворсин – в 48 (41,4%), децидуит – в 38 (31,9%), уменьшение плодово-плацентарного коэффициента – в 42 (36,2%) случаев.
В ходе нашего исследования выявлены достоверные отличия в содержании сосудистых факторов роста в сыворотке крови у пациенток, беременность которых осложнилась ПН и СЗРП, по сравнению со здоровыми беременными. Уровень sFlt-1 у беременных основной группы в 5,5 раз выше по сравнению с контрольной группой и составил 19438,6±3131,8 и 3492,4±552,5 pg/ml соответственно (p<0,05) (см. рис. 1). Уровень s-Eng у беременных основной группы был в 3,3 раза выше по сравнению с контрольной группой и составил 17483±5865 и 5258±670 pg/ml соответственно (p<0,05). Концентрация PlGF у беременных основной группы в 1,5 раза меньше по сравнению со здоровыми беременными и составила 146,5±45 и 239,1±66,9 pg/ml соответственно (p<0,05) (см. рис. 1).
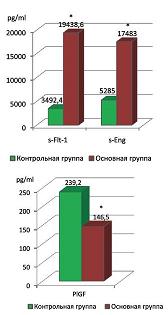 | Рисунок 1: Уровень сосудистых факторов роста основной и контрольной групп.
*Разница достоверна по сравнению с контрольной группой (p<0,05). |
Таким образом, нарушение формирования фетоплацентарного комплекса характеризуется снижением уровня проангиогенного фактора роста и повышением уровня антиангиогенных факторов роста.
При анализе показателей сосудистых факторов роста определен ангиогенный коэффициент (Ка), определяемый по формуле Ка=sFlt-1/PlGF-10 и отражающий глубину сосудистых нарушений и выраженность сосудистого дисбаланса. У пациенток основной группы величина Ка в 40 раз превышала значения Ка здоровых беременных и составила 61,4±26,3 по сравнению с 1,5±0,9 (p<0,05) (см. рис. 2).
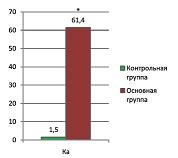 | Рисунок 2: Уровень ангиогенного коэффициента Ка (отражает глубину сосудистых нарушений и выраженность сосудистого дисбаланса) в обследованных группах.
*Разница достоверна по сравнению с контрольной группой (p<0,05). |
Таким образом, тяжелая ПН и СЗРП сопровождается выраженными сосудистыми нарушениями и дисбалансом сосудистых факторов роста, что отражается на резком возрастании значений Ка. Нами проведен анализ уровня сосудистых факторов роста и ангиогенного коэффициента Ка у беременных в зависимости от степени тяжести СЗРП. У беременных с СЗРП III степени уровень PlGF достоверно ниже по сравнению с беременными с СЗРП II и I степени: 20,9±11,1; 39,8±28,2 и 209,8±85,7 соответственно (p<0,05). При этом уровень PlGF достоверно ниже у беременных с СЗРП II степени по сравнению с группой с СЗРП I степени. У беременных с СЗРП II и III степени уровень PlGF достоверно ниже по сравнению со здоровыми: 20,9±11,1, 39,8±28,2 и 239,1±66,8 соответственно (p<0,05). У беременных с СЗРП I степени уровень PlGF достоверно не отличался от контрольной группы, но имел тенденцию к снижению.
Значения PlGF у беременных с СЗРП II степени в 6 раз меньше по сравнению с контрольной группой. А у беременных с СЗРП III степени значения PlGF оказались меньше значений контрольной группы в 11,5 раз (см. рис. 3).
 | Рисунок 3: Концентрация сосудистых факторов роста в исследуемых группах (СЗРП – синдром задержки роста плода).
*Разница достоверна по сравнению с контрольной группой (p<0,05). |
При сравнении значений Ка в основной группе было выявлено резкое возрастание Ка от 18,5 в подгруппе беременных с СЗРП I степени до 107,4 и 136,5 в подгруппах пациенток с СЗРП II и III степени соответственно (см. рис. 4).
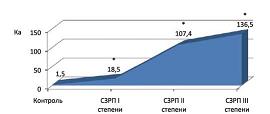 | Рисунок 4: Значения ангиогенного коэффициента Ка (отражает глубину сосудистых нарушений и выраженность сосудистого дисбаланса) в исследуемых группах (СЗРП – синдром задержки роста плода).
*Разница достоверна по сравнению с контрольной группой (p<0,05). |
Выводы
При физиологическом течении беременности проангиогенные и антиангиогенные сосудистые факторы находятся в состоянии равновесия, обеспечивая адекватную имплантацию и плацентацию, необходимую для последующего нормального развития плода. Плацентарная недостаточность и СЗРП характеризуются увеличением антиангиогенных сосудистых факторов роста и снижением проангиогенного фактора, нарастанием их дисбаланса, что приводит к усугублению маточно-плацентарной гипоксии и ухудшению состояния плода.
Выраженность дисбаланса сосудистых факторов определяет глубину сосудистых нарушений в маточноплацентарном комплексе и, как следствие, степень его поражения и тяжесть ПН, которая также будет зависеть от скорости развития дисбаланса и компенсаторно-приспособительных возможностей материнского организма.
Снижение уровня PlGF у пациенток основной группы обусловлено уменьшением плацентарной ткани, что находит отражение в результатах плацентографии, при которой диагностирована в большом проценте случаев гипоплазия плаценты и уменьшение ее площади, что впоследствии подтвердилось морфологическим исследованием плаценты, которое выявило высокую частоту встречаемости гипоплазии плаценты с уменьшением значения плодово-плацентарного коэффициента. А в основной группе выявлено значительное повышение уровня антиангиогенных факторов, которые конкурентно связывались со свободно циркулирующими PlGF, уменьшая тем самым их абсолютное значение.
Таким образом, поиск дополнительных патофизиологических механизмов, лежащих в основе формирования ПН, является перспективным направлением как для научных исследований, так и для практического здравоохранения. Глубокое понимание патологических аспектов формирования ПН поможет разработать комплекс мероприятий по своевременной диагностике, адекватному лечению и выработке правильной тактики ведения беременности с целью снижения перинатальных осложнений и потерь.
Литература:
1. Евсеева З.П., Сагамонова К.Ю., Палиева Н.В., Заманская Т.А., Маркарьян И.В., Мелконов Э.Ю. Критерии ранней диагностики фетоплацентарной недостаточности и синдрома задержки роста плода. Российский вестник акушера-гинеколога. 2008; 3: 12-21.
2. Крымшокалова З.С., Орлов В.И., Подгорная O.A., Щекатурина Е.В. Оценка маточно-плацентарного и фетоплацентарного кровотока при задержке роста плода. Российский вестник акушера-гинеколога. 2008; 3: 67-77.
3. Кузьмин В.Н. Фетоплацентарная недостаточность: проблема современного акушерства. Лечащий врач. 2011; 3: 50-54.
4. Кулаков В.И., Орджоникидзе Н.В., Тютюнник В.Л. Плацентарная недостаточность и инфекция. Руководство для врачей. М.2004; 494 с.
5. Макацария А.Д., Бицадзе В.О., Баймурадова С.М., Передеряева Е.Б., Пшеничникова Т.Б., Хизроева Д.Х., Донина Е.В., Акиныпина С.В. Профилактика повторных осложнений беременности в условиях тромбофилии. Руководство для врачей. М. 2008; 152 с.
6. Милованов А.П., Савельева С.В. Внутриутробное развитие человека: руководство для врачей. М. 2006; 384 с.
7. Николаева Л.Б., Тришкин А.Г., Колядов В.А. Эхографические и морфологические особенности плаценты у первородящих женщин. Российский вестник акушера-гинеколога. 2009; 4: 3-6.
8. Савельева Г.М., Курцер М.А., Шалина Р.И. Материнская смертность и пути ее снижения. Акушерство и гинекология. 2009; 3: 11-15.
9. Соколов Д.И. Васкулогенез и ангиогенез в развитии плаценты // Журнал акушерства и женских болезней. 2007; 3.
10. Стрижаков А.Н., Кузьмина Т.Е. Беременность после кесарева сечения: течение, осложнения, исходы. Вопросы гинекологии, акушерства и перинатологии. 2002; 1 (2): 40-46.
11. Стрижаков А.Н., Мусаев З.М., Тимохина Т.Ф., Наумчик Б.И., Буданцева А.В., Системные нарушения гемодинамики при синдроме задержки роста плода как фактор риска гипоксически-ишемических поражений ЦНС и отклонений психомоторного развития детей. Акушерство и гинекология. 2003; 1: 11-6.
12. Burton G.I., Charnock-Jones D.S., Jauniaux E. Regulation of vascular growth and function in the human placenta. Reproduction. 2009; 138: 895-902.
13. Guillermina Girardi, Dmitry Yarilin. Complement activation induces dysregulation of angiogenic factors and causes fetal rejection and growth restriction, 2006.
14. Malamitsi-Puchner A., Boutsikou T., Economou E., Sarandakou A., Makrakis E., Hassiakos D., Creatsas G. Vascular endothelial growth factor and placenta growth factor in intrauterine growth-restricted fetuses and neonates. Mediators Inflamm. 2005 Oct. 24; (5): 293-7.
15. Mandruzzato G.P., Intrauterine growth restriction (IUGR): guidelines for definition, recognition and management, Archives of Perinatal Medicine. 2008; 14: 7-8.
16. Mitra S.C., Seshan S.V., Riachi L.E. Placental vessel morphometry in growth retardation and increased resistance of the umbilical artery Doppler flow. J. Matern. Fetal. Med. 2000 Sep-Oct; 9 (5): 282-6.
17. Redman C.W. Sargent II.: Latest advances in understanding preeclampsia. Science 2005; 308: 1592-4.
18. Romero R. et al. A longitudinal study of angiogenic (placental growth factor) and antiangiogenic (soluble endoglin and soluble vascular endothelial growth factor receptor-1) factors in normal pregnancy and patients destined to develop preeclampsia and deliver a small for gestational age neonate. J. Matern. Fetal. Neonatal. Med. 2008; 21 (1): 9-23.
19. Romero R., Erez O., Espinoza J. et al. The change in concentrations of angiogenic and anti-angiogenic factors in maternal plasma between the first and second trimesters in risk assessment for the subsequent development of preeclampsia and small-for-gestational age. J. Matern. Fetal. Neonatal. Med. 2008; 21 (5): 279-287.
20. Smotrich D.B., Stilman R.G., Widra E.A., Gindoff P.R., Kaplan P., Graubert M., Johnson K.E. Immunocytochemical localization of growth factors and their receptors in human pre-embryos and Fallopian tubes. Hum. Reprod. 1996; 11 (1): 184-190.
21. Sugino N., Kashida S., Karube-Harada A., Takiguchi S., Kato H. Expression of vascular endothelial growth factor (VEGF) and its receptors in human endometrium throughout the menstrual cycle and in early pregnancy. Reproduction. 2002 Mar; 123 (3): 379-87.
22. Sugimoto H., Hamano Y., Charytan D., Cosgrove D., Kieran M., Sudhakar A., Kalluri R. Neutralization of circulating vascular endothelial growth factor (VEGF) by anti-VEGF antibodies and soluble VEGF receptor 1 (sFlt-1) induces proteinuria. J. Biol. Chem. 2003 Apr 11; 278 (15): 12605-8. Epub 2003 Jan 21.
23. Wallner W., Sengenberger R., Strick R. et al. Angiogenic growth factors in maternal and fetal serum in pregnancies complicated by intrauterine growth restriction. Clin. Sci (Lond). 2007; 112 (1): 51-57.
FETOPLACENTAL ANGIOGENESIS IN PREGNANT WOMEN WITH PLACENTAL INSUFFICIENCY
Makarov O.V., Volkova E.V., Lysyuk E.Yu., Kopylova Yu.V.
Russian National Research Medical University named after N.I. Pirogov of the Ministry of Health of the Russian Federation (Moscow)
Abstract: the article presents the results of the studing of fetoplacental angiogenesis, as the reason of placenta malfunction and featus progress.
The objective: the examination included 116 pregnant famale patients with placental insufficiency and growth retardation syndrome and 52 pregnant famale patients with physiological pregnancy.
Results: it was determined that proangiogenic vessel factor – placental growth factor (P1GF) and angiogenic vessel factors are the soluble fms-like tyrozinkinaze (sFlt-1) and soluble endogline (sEng).
There was determined angiogenic coefficient – Ka, calculated in formule sFlt-1/PlGF×10.
Conclusion: it was revealed that placental insufficiency characterized falure balance of vessel growth factors, enlarged levels of angiogenic vessel factors and low levels of proangiogenic factor. For the development of placental insufficiency and enlarged stage of growth retardation syndrome the increasion of angiogenic coefficient Ka is typical.
Key words: angiogenesis, placental insufficiency, growth retardation syndrome, vessel growth factors, angiogenic coefficient Ka. |
|