АНАЛИЗ РЕЗУЛЬТАТОВ ОПЕРАТИВНОГО ЛЕЧЕНИЯ ЖЕНЩИН С НЕДЕРЖАНИЕМ МОЧИ: МОРФОЛОГИЧЕСКИЕ АСПЕКТЫ.
Неймарк А.И.1, Раздорская М.В.2, Гервальд В.Я.1, Шарапов В.В.2, Шашев Н.С.2 Дата публикации на сайте: 2013-03-07 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
Морфологические изменения парауретральной ткани у женщин с рецидивом стрессового недержания мочи свидетельствуют о неполноценности или дисплазии соединительной ткани, что может являться причиной низкой эффективности методик с использованием собственных тканей для коррекции пролапса и недержания мочи и определяет необходимость применения синтетических материалов.
Ключевые слова: стрессовое недержание мочи, дисплазия соединительной ткани
1 Алтайский государственный медицинский университет, Барнаул
2 НУЗ «Отделенческая клиническая больница на ст. Барнаул ОАО «РЖД»
Актуальность проблемы недержания мочи у женщин обусловлена высокой распространенностью и частотой рецидивов после оперативного лечения [7,8]. Распространенность заболевания в нашей стране и во многих странах мира составляет около 30%, а в старшей возрастной группе достигает 50% [4]. Очевиден тот факт, что современные женщины не желают мириться с состоянием, которое существенно снижает качество их жизни, степень социальной активности, а также требует материальных затрат. Существует множество факторов, которые играют роль в развитии стрессового недержания мочи. Утрата нормального тонуса соединительно-тканных образований и связок, поддерживающих шейку мочевого пузыря и проксимальный отдел уретры, является основным патогенетическим звеном в развитии заболевания [12]. При этом шейка мочевого пузыря теряет способность полностью замыкать выход из пузыря, поскольку в состоянии напряжения смещается патологически низко, возникает непроизвольное отделение мочи. Принято считать, что наиболее значимыми факторами риска стрессового недержания мочи являются возраст, повреждения тазового дна при родах, ожирение, дисплазия соединительной ткани, операции на органах малого таза, менопауза. Хирургическое лечение больных со стрессовым недержанием мочи проводится уже в течение более 130 лет. К настоящему времени предложено более 200 различных видов операций, но ни один из них не дает 100% выздоровления [1,5]. Причем, количество рецидивов как недержания мочи, так и опущения стенок влагалища, с течением времени увеличивается.
Последнее время в литературе все чаще встречаются результаты исследований урогинекологических больных на предмет дисплазии соединительной ткани. Нарушение структуры соединительной ткани имеет прямую связь с развитием стрессового недержания мочи, пролапсом тазовых органов и возникновением паравагинальных дефектов [2,6,9]. Типы коллагена различны у здоровых женщин и у больных стрессовым недержанием мочи [13,15]. Keane D.P. (1997) исследовал коллаген нерожавших женщин в перименопаузе и сравнил с аналогичной группой здоровых пациенток. При анализе биоптатов эндопельвикальной фасции у нерожавших женщин с признаками стрессового недержания мочи имелось значительное снижение коллагена по сравнению со здоровыми. Основными факторами риска в развитии стрессовой инконтиненции считают изменение соединительной ткани в сочетании с одним из перечисленных ниже факторов: беременность, возраст больной и гормональный статус. Ulmsten U. (1997) и соавторы обнаружили, что у женщин со стрессовым недержанием мочи снижение общего коллагена в круглой связке и разрезе кожи в сравнении со здоровыми женщинами составляет 40% и предположили, что снижение коллагена приводит к нарушению поддерживающего урогенитального аппарата и способствует уменьшению гипермобильности шейки мочевого пузыря. В этих работах также имеются указания на наличие грыж живота, варикозного расширения вен нижних конечностей и пролапса матки у женщин со стрессовым недержанием мочи. Versi Е. (1990) исследовал общий коллаген в биоптатах кожи и обнаружил, что высокое содержание коллагена сочетается с повышением уретрального давления в покое и при напряжении. Возможно, большее значение для развития недержания мочи имеют биохимические изменения, происходящие в соединительной ткани при беременности, к которым относится повышение синтеза релаксина и простагландинов, что может влиять на обменные процессы коллагена, входящего в структуру соединительной ткани связочного аппарата, участвующего в процессе удержания мочи [10,11]. Возможно, что у женщин эстрогенный дефицит при старении вызывает ускоренные дегенеративные процессы в соединительной ткани, что влияет на механизм уретральной поддержки и может способствовать развитию или усугублению в климактерии недержания мочи [3,14].
Таким образом, дисплазия соединительной ткани, проявляющаяся качественными и количественными изменениями коллагена, усугубляется эстрогенным дефицитом в климактерии, что является важнейшим фактором, влияющим на состав соединительной ткани и ее биохимические характеристики у женщин с недержанием мочи, а также причиной рецидивов оперативного лечения.
Цель настоящего исследования – анализ результатов оперативного лечения женщин с несостоятельностью тазового дна (опущением передней и задней стенок влагалища) и стрессовым недержанием мочи. Морфологическое исследование парауретральной ткани у женщин, перенесших пластическую операцию по поводу стрессового недержания мочи и обратившихся с рецидивом недержания мочи.
Материалы и методы
В период с 2000 по 2011 г. нами оценены результаты обследования 716 женщин со стрессовым недержанием мочи в возрасте 21-72 лет, которые подверглись оперативному лечению. Исследуемым пациенткам проводилась операция – передняя кольпорафия с пластикой сфинктера мочевого пузыря – по общепринятой методике в нашей модификации, цистоуретропексия (фиксация парауретральных тканей и шейки мочевого пузыря к передней брюшной стенке посредством лигатур – оригинальная методика), задняя кольпорафия с перинеолеваторопластикой.
Рецидив недержания мочи отметили 129 (18%) пациенток, при этом результатом оперативного лечения все же были довольны 65 пациенток – это половина из всех обратившихся. Однако 64 пациентки отмечали неудовлетворительный результат и из них 17 женщин настаивали на повторной операции, причем осмотр на кресле не выявил у них опущения стенок влагалища. Рецидив опущения стенок влагалища при осмотре на кресле был выявлен у 72 (10%) пациенток после операции.
Таким образом, 17 женщин поступили в отделение урологии для оперативного лечения по поводу рецидива стрессового недержания мочи без опущения стенок влагалища. Всем пациенткам под в/в анестезией была выполнена операция – TVT, при этом после выделения средней трети уретры из парауретрального пространства бралась ткань для морфологического исследования.
Материал для морфологического исследования фиксировали в 10% нейтральном формалине забуференном по Лили. Далее проводили стандартным способом и заливали в парафин. Впоследствии делали срезы толщиной 4-5 мкм. Приготовленные стеклопрепараты окрашивали гематоксилином и эозином, для выявления коллагеновых волокон пикрофуксином по ван Гизон и резорцин-фуксином по Вейгерту для выявления эластических волокон.
Результаты исследования
При окраске гематоксилином и эозином во всех исследуемых материалах была обнаружена воспалительная инфильтрация, располагающаяся субэпителиально. Степень выраженности инфильтрата от слабой до выраженной. Преимущественный состав воспалительного инфильтрата – лимфо-макрофагальный (см. рис. 1-2). На рисунке 3 представлен вариант нормы.
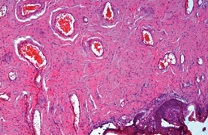 | Рисунок 1: Фрагмент мягких тканей с умеренной субэпителиальной воспалительной инфильтрацией. Окраска гематоксилином и эозином. Увел. ×200. |
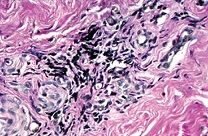 | Рисунок 2: Фрагмент мягких тканей с умеренной субэпителиальной воспалительной инфильтрацией. Окраска гематоксилином и эозином. Увел. ×400. |
 | Рисунок 3: Вариант нормального строения (эпителий и подлежащие ткани без воспаления). |
При окраске пикрофуксином по ван Гизон зафиксированы дегенеративные изменения коллагеновых волокон, проявляющиеся очагами желтого окрашивания, в то время как коллагеновые волокна на всем протяжении окрашиваются пикрофуксином в темно-красный цвет (см. рис. 4).
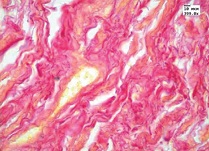 | Рисунок 4: Коллагеновые волокна с дистрофическими изменениями в виде очагов желтого окрашивания. Окраска пикрофуксином по ван Гизон. Увел. ×400. |
Коллагеновые волокна имели извитой вид, располагались в виде густой переплетающейся сети. Часть волокон были фрагментированы с поперечными разрывами, утолщениями по ходу волокна.
В целом, в морфологической картине отмечали чередование очагов разряжения (см. рис. 5), где большинство коллагеновых волокон были короткие фрагментированные слабо извитые, и очагов с явным увеличением содержания коллагеновых волокон вплоть до формирования очагов склероза со значительным утолщением коллагеновых волокон и пучков (см. рис. 6).
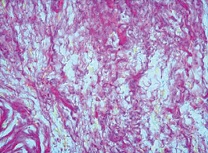 | Рисунок 5: Короткие и фрагментированные коллагеновые волокна. Окраска пикрофуксином по ван Гизон. Увел. ×400. |
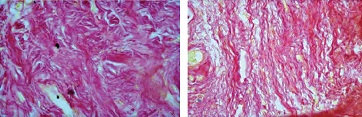 | Рисунок 6: Различной степени выраженности очаговые изменения коллагеновых волокон в мягких тканях в виде полей склероза и утолщения коллагеновых волокон и пучков. Окраска пикрофуксином по ван Гизон. Увел. ×400. |
При окраске на эластические волокна резорцинфуксином по Вейгерту в мягких тканях отмечено, что эластические волокна распределены неравномерно, их количество резко снижено. Кроме этого, были отмечены изменения эластических волокон в виде набухания и образования глыбок. Значительная часть волокон была представлена в виде зерен («зернистый» распад эластических волокон), палочек или лент, хорошо окрашивающихся резорцин-фуксином в темно-синий цвет (см. рис. 7-9).
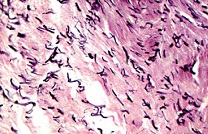 | Рисунок 7: Эластические волокна фрагментированы в виде палочек. Окраска резорцин-фуксином по Вейгерту. Увел. ×400. |
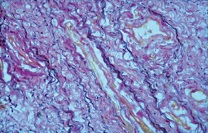 | Рисунок 8: Эластические волокна фрагментированы в виде лент. Окраска резорцин-фуксином по Вейгерту. Увел. ×400. |
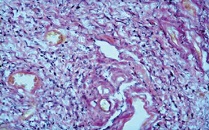 | Рисунок 9: Эластические волокна фрагментированы в виде зерен. Окраска резорцин-фуксином по Вейгерту. Увел. ×400. |
Заключение
В исследуемых парауретральных тканях выявлены морфологические изменения коллагеновых волокон: фрагментация, дегенеративные изменения (желтое окрашивание по ходу волокна), утолщение их с формированием полей склероза. Наряду с этими изменениями выявлены дегенеративные изменения эластических волокон (их зернистый распад, фрагментация, снижение количества). Все это может приводить к значительной утрате эластических свойств исследуемых тканей, нарушая их растяжимость и повреждая мышечно-эластический каркас. На наш взгляд, именно повреждения соединительно-тканного матрикса (коллагеновые и эластические волокна) являются причиной рецидива недержания мочи. Итак, морфологически в парауретральном пространстве обнаружен фиброз – как следствие длительного нарушения анатомической позиции уретровезикального сегмента или оперативного вмешательства, что приводит к снижению эластичности тканей, нарушению микроциркуляции. В данном случае патогенетически обосновано консервативное лечение и/или при неэффективности использование синтетических материалов с учетом несостоятельности собственной соединительной ткани. Учитывая, что все обследованные нами пациентки находились в менопаузе, то основу консервативного лечения составила местная гормонзаместительная терапия, улучшающая качественные характеристики коллагена, что значительно улучшило качество жизни, а при легкой степени недержания мочи избавило от этого недуга.
Выводы
Таким образом, обнаруженные морфологические изменения парауретральной ткани у женщин с рецидивом стрессового недержания мочи свидетельствуют о неполноценности или дисплазии соединительной ткани, что может являться причиной низкой эффективности методик с использованием собственных тканей для коррекции пролапса и недержания мочи и определяет необходимость применения синтетических материалов. Дальнейшее изучение морфологических аспектов проблемы пролапса гениталий и стрессового недержания мочи у женщин позволит осуществлять дифференцированный выбор тактики ведения и повысить эффективность лечения с учетом патогенетических и этиологических моментов развития данной патологии.
Литература:
1. Айламазян Э.К., Беженарь В.Ф., Савицкий Г.А. Алгоритмы диагностики и хирургического лечения больных с недержанием мочи. Акушерство и гинекология. 2007; 1: 34-39.
2. Буянова С.Н., Савельев С.В., Петрова В.Д. Роль дисплазии соединительной ткани в патогенезе пролапса гениталий и недержания мочи. Рос. вестн. акуш-гин. 2005; 5: 15-18.
3. Камоева С.В. Ферментные и генетические аспекты патогенеза пролапса тазовых органов и дисфункции тазового дна у женщин. Российский вестник акушера-гинеколога. 2012; 3: 31-35.
4. Лоран О.Б. Эпидемиология, этиология, патогенез, диагностика недержания мочи: в кн. Материалы пленума правления Рос. общества урологов. М. 2001; 21-41.
5. Лоран О.Б. Современные методы лечения недержания мочи и пролапса органов малого таза. Пособие для врачей. М. 2006; 44 с.
6. Лоран О.Б., Синякова Л.А., Шишло В.К., Королев П.В. Клеточные изменения в парауретральной зоне экспериментальных животных при воздействии геля коллост. Урология. 2012; 3: 19-22.
7. Пушкарь Д.Ю., Гумин Л.М. Тазовые расстройства у женщин. М. 2006; 256 с.
8. Савицкий Г.А., Савицкий А.Г. Недержание мочи в связи с напряжением у женщин. СПб. 2000; 136 с.
9. Смольнова Т.Ю., Буянова С.Н., Савельева С.В., Петрова В.Д. Дисплазия соединительной ткани как одна из возможных причин недержания мочи у женщин с пролапсом гениталий. Урология. 2001; 2: 25-30.
10. Смольнова Т.Ю. Клинико-патогенетические аспекты опущения и выпадения внутренних половых органов и патологии структур тазового комплекса у женщин при дисплазии соединительной ткани: тактика ведения: автореф. дис. докт. мед. наук. М. 2009; 57 с.
11. Строни Ровена. Хирургическое лечение урогенитальных расстройств у женщин в постменопаузальном периоде. Автореф. дис. канд. мед. наук. М. 2011; 20 с.
12. Шамов Д.А. Свободная синтетическая петля в оперативном лечении женщин, страдающих стрессовым недержанием мочи: Автореф. дис. канд. мед. наук. М. 2002; 22с.
13. Keane D.P., Sims T.J., Abrams P. et al. Analysis of collagen status in premonopausal nulliparous women with genuine stress incontinence. Obstet. Gynecol. 1997; 9: 994-998.
14. Mushkat Y., Bukovsky I., Langer R. Female urinary stress incontinence does it have a familial prevalence? Am. J. Obstet. Gynecol. 1996; 2: 617-619.
15. Norton P., Boyd C., Deak S. Collagen synthesis in women with genital prolapse of stress urinary incontinence. Neurourol. Urodyn. 1992; 300-301.
THE ANALYSIS OF RESULTS OF SURGICAL TREATMENT OF URINARY INCONTINENCE IN WOMEN: MORPHOLOGICAL ASPECTS
Neimark A.I., Razdorskaya M.V., Gervald V.Ya., Sharapov V.V., Shashev N.S.
Department of Urology Altay State Medical University, Barnaul
Abstract: Anatomic changes ofparaurethral tissue in women with relapse of urinary incontinence due to stress may testify deficiency or dysplasiaof connective tissue. These may serve as reason of low efficacy of methods with use of own tissues for prolapse correction and urinary incontinence management. These determine the necessity of synthetic materials use.
Key words: stress urinary incontinence, connective tissue dysplasia. |
|