КОМБИНИРОВАННЫЕ ОРАЛЬНЫЕ КОНТРАЦЕПТИВЫ В ЛЕЧЕНИИ ПАЦИЕНТОК С СИНДРОМОМ ПОЛИКИСТОЗНЫХ ЯИЧНИКОВ.
Геворкян М.А.1, Блинов Д.В.2, Смирнова С.О.1 Дата публикации на сайте: 2012-07-07 Доступна также в печатной версии журнала Резюме | Полный текст | Скачать в PDF
Резюме:
Синдром поликистозных яичников (СПКЯ) является актуальной проблемой в гинекологии. В настоящее время не завершены дискуссии о классификации и критериях диагностики СПКЯ. Наиболее распространенными являются критерии, принятые Роттердамским консенсусом экспертов в 2003 г.: диагноз СПКЯ ставится, если у женщины одновременно присутствуют два из трёх следующих признаков: симптомы избыточной активности или избыточной секреции андрогенов (клинические или биохимические); олигоовуляция или ановуляция; поликистозные яичники при ультразвуковом исследовании (УЗИ). Важную роль в терапии пациенток с СПКЯ играют комбинированные оральные контрацептивы (КОК). Оправданно делать выбор в пользу монофазных КОК с прогестагенами последнего поколения, такими как дроспиренон. Применение КОК с антиандрогенным действием патогенетически обосновано и способствует нормализации уровней лютеинизирующего гормона (ЛГ), снижению продукции андрогенов в яичниках, уменьшению их объема, а также положительно влияет на такие проявления СПКЯ, как увеличение массы тела, гирсутизм и угревую сыпь.
Ключевые слова: СПКЯ, гирсутизм, акне, КОК, ГнРГ, ЛГ, ФСГ, эстрадиол, дроспиренон
1 ГБОУ ВПО «Московский государственный медико-стоматологический университет» Минздравсоцразвития России
2 ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздравсоцразвития России
Введение
Синдром поликистозных яичников (СПКЯ) является одной из актуальных проблем гинекологической эндокринологии. В частности, СПКЯ – одна из наиболее частых причин нарушения менструальной и репродуктивной функции, что может приводить к бесплодию эндокринного генеза. СПКЯ - это гетерогенное заболевание с многофакторным патогенезом, характеризующимся овариальной и, в 50% наблюдений, овариально-надпочечниковой гиперандрогенией; инсулинрезистентностью и, как следствие, гиперинсулинемией независимо от массы тела [19,26]. При развитии заболевания происходит мультикомпонентное повреждение органов репродуктивной системы женщины, при этом на стадии клинических проявлений СПКЯ носит затяжной и необратимый характер [17]. Все это подчеркивает актуальность проблемы СПКЯ и необходимость контролировать его проявления с применением различных методов терапии и профилактики.
О поликистозном перерождении яичников сообщали еще Cherean (1845 г.), К.Ф. Славянский (1893 г.), С.К. Лесной (1928 г.) и Е.Е. Гиговский (1930 г.) [4,16]. Однако соответствующий симптомокомплекс (ожирение, гирсутизм, аменорея и увеличенные в размерах яичники) был впервые выявлен более 70 лет назад, когда И. Штейн и М. Левенталь описали семь пациенток с аменореей и поликистозной морфологией яичников. Консервативное лечение данных пациенток оказалось неэффективным, после чего было предпринято хирургическое вмешательство, в ходе которого были обнаружены увеличенные яичники с утолщенной капсулой и множеством мелких фолликулов [16,30]. Определение «болезнь поликистозных яичников» с течением времени было признано не вполне корректным, т.к. это состояние характеризуется не как болезнь, т.е. отдельная нозологическая форма, а как клинико-патогенетический синдром, причины которого могут быть различны.
Термин «Синдром поликистозных яичников» впервые был предложен и утвержден на одном из заседаний ВОЗ в 1984 году. Первое определение СПКЯ было выработано консенсусом экспертной комиссии, разрабатывавшей подходы к диагностике данного заболевания в Америке под эгидой Национального института детского здоровья и развития человека (National Institute of Child Health and Human Development, NICHD, США) и американского Национального института здравоохранения (National Institutes of Health, NIH, США) в 1990 г. [29]. Согласно этому определению, пациентке должен быть поставлен диагноз СПКЯ, если у неё одновременно присутствуют: симптомы избыточной активности или избыточной секреции андрогенов (клинические и/или биохимические); олигоовуляция или ановуляция при исключении других причин, способных вызывать поликистоз яичников.
По заключению Роттердамского консенсуса, проходившего с участием экспертов Европейского общества фертильности и эмбриологии (European Society of Human Reproduction and Embryology, ESHRE) и Американского общества репродуктивной медицины (American Society for Reproductive Medicine, ASRM) в 2003 г., критерии диагностики СПКЯ были расширены, что привело к увеличению частоты данного заболевания в популяции [6,19]. По этому определению диагноз СПКЯ ставится, если у женщины одновременно присутствуют любые два из трёх следующих признаков: симптомы избыточной активности или избыточной секреции андрогенов (клинические или биохимические); олигоовуляция или ановуляция; поликистозные яичники при ультразвуковом исследовании (УЗИ) и если при этом исключены другие причины, которые могут вызвать поликистоз яичников. Понятно, что определение, принятое Роттердамским консенсусом экспертов, является значительно более широким, и под данные критерии потенциально может попасть значительно больше пациенток, чем под критерии консенсуса 1990 года, поскольку обязательными для постановки диагноза являются любые два из трёх признаков, а не все три. Так, в качестве пациенток с СПКЯ здесь могут быть расценены и женщины без клинических или биохимических признаков избытка андрогенов, в то время как в американском определении избыточная секреция или избыточная активность андрогенов является обязательным условием для диагноза СПКЯ.
Не исключено, что в будущем критерии постановки диагноза СПКЯ еще будут уточняться. В научной литературе существует немало критических статей, где Роттердамское определение подвергается сомнению [21,24]. Их авторы придерживаются мнения, что данные, полученные при исследованиях с участием пациенток с избытком андрогенов, не обязательно могут быть экстраполированы на пациенток без гиперандрогении.
В России пользовались классификацией, основанной на систематизации многочисленных клинических гормональных и морфологических исследований, которая выделяла первичные и вторичные поликистозы яичников (ПКЯ). Первичные ПКЯ сформированы в пубертатном периоде, а вторичные являются исходом различной эндокринной патологии в репродуктивном возрасте: метаболический синдром (нейрообменно-эндокринный синдром), гиперпролактинемии, болезни Кушинга и др. Однако, следует отметить, что при длительном существовании вторичных ПКЯ их макро- и микроскопическая характеристика не отличается от таковой при первичных ПКЯ. И основную роль в этом играет длительность хронической ановуляции и яичниковой гиперандрогении, а также сопутствующие метаболические нарушения. В настоящее время в России применительно к первичным ПКЯ используется единый термин – СПКЯ [4,7].
Эпидемиология
Эпидемиологические данные весьма разнятся, т.к. в ходе исследований по-разному интерпретируются гетерогенные клинические и эндокринологические проявления. С учетом диагностических критериев консенсуса 1990 г. частота встречаемости этого заболевания составляет от 1 до 7 % [16]. Если ориентироваться на Роттердамские критерии определения СПКЯ, как на выработанные последним по времени консенсусом международных экспертов и не утратившие своей актуальности, то необходимые клинические признаки, позволяющие поставить диагноз СПКЯ, обнаруживаются не менее чем у 5-10% женщин репродуктивного возраста [8]. При этом по УЗИ у каждой четвертой женщины выявляются поликистозные яичники, хотя и не у всех имеется симптомокомплекс, характерный для СПКЯ. По другим данным, СПКЯ встречается у примерно у 15% женщин репродуктивного возраста, у 73% пациенток с ановуляторным бесплодием, у 85% женщин с гирсутизмом и у 95% – с гиперандрогенией [25]. По данным российских исследователей СПКЯ выявляется у 70% пациенток с ановуляторным бесплодием, у 65% женщин с андрогенезависимыми дерматопатиями и у 55% пациенток с различными формами гиперандрогении [4]. Признано, что СПКЯ является наиболее частым гормональным расстройством у женщин репродуктивного возраста и одной из ведущих причин эндокринного бесплодия.
Этиология и патогенез
Т.к. актуальность СПКЯ в последнее десятилетие существенно возросла, в мире предпринимается все большее количество научных и экспериментальных исследований, посвященных СПКЯ. Продолжается интенсивное изучение механизмов развития СПКЯ на уровне гипоталамо-гипофизарного комплекса, яичников, надпочечников, жировой ткани. Подтверждена роль метаболических нарушений, включая аутопаракринные факторы регуляции овариального стероидогенеза. Фактором, играющим ключевую роль при возникновении СПКЯ, признана яичниковая (овариальная) гиперандрогения. Однако на сегодня весь спектр причин возникновения СПКЯ во многом остается неизвестным.
Современные представления о механизмах яичниковой гиперандрогении представляют большой практический интерес, т.к. позволяют проследить взаимосвязь между первичными нарушениями гормональных и ферментных систем организма с развитием клинических проявлений СПКЯ.
Нарушение секреции гонадотропных гормонов
Как известно, репродуктивная система имеет несколько уровней нейро-гуморальной регуляции. Первый уровень – кора головного мозга, где в регуляции участвуют амигдаловидные ядра больших полушарий и структуры лимбической системы, о чем свидетельствует наступление аменореи после нарушения проницаемости гематоэнцефалического барьера при травмах, гипоксических и токсических поражениях, сопровождающихся выходом нейроспецифических антигенов в периферический кровоток [2]. Второй уровень – гипоталамус, выступающий в роли «водителя ритма» в репродуктивной системе. Там вырабатываются рилизинг-гормоны, в частности, гонадотропный рилизинг-гормон (ГнРГ), стимулирующий секрецию фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ), а также либерины (стимуляторы) и статины (ингибиторы), влияющие на следующий уровень нейро-гуморальной регуляции. Третий уровень – секреция ФСГ, ЛГ и пролактина гипофизом. Четвертый уровень – секреция в яичниках эстрогенов и прогестерона с повышением их выработки в 1-ю и 2-ю фазу менструального цикла, соответственно, под влиянием ЛГ и ФСГ. Наконец, пятым уровнем нейро-гуморальной регуляции репродуктивной системы женщины является матка, где происходит отторжение функционального слоя эндометрия в период менструации вследствие снижения уровня женских половых гормонов в крови в связи с регрессом желтого тела.
Полноценное взаимодействие вышеперечисленных уровней регуляции устанавливается к возрасту менархе, когда формируется цирхоральная секреция ГнРГ гипоталамусом.
Согласно гипотезе о первичном нарушении цирхорального ритма выделения ГнРГ с периода пубертата, возможно, генетически детерминированное, или происходит в результате воздействия различных внешних факторов.
Повышенная секреция ЛГ приводит к избыточному уровню ЛГ и нарушению фолликулогенеза, формированию кистозной атрезии фолликулов, гиперплазии клеток теки, стромы и увеличению синтеза андрогенов. Развивается относительный дефицит ФСГ, который необходим для синтеза ферментов (цитохром Р450-аром и др.), под влиянием которых происходит метаболизм андрогенов в эстрогены. Вследствие этого увеличивается концентрация андрогенов и снижается продукция эстрадиола.
Избыточный уровень андрогенов
Считается, что избыточная секреция андрогенов в надпочечниках в период адренархе (препубертат) может способствовать развитию СПКЯ. Они метаболизируются в эстрон в жировой ткани, который нарушает чувствительность гипофиза к ГнРГ, что приводит к повышенной продукции ЛГ. При этом увеличение количества жировой ткани, которая участвует в метаболизме половых гормонов, находится в линейной зависимости с уровнем внегонадных андрогенов и эстрона, а также влечет за собой увеличение массы тела. Таким образом, формируется «порочный круг» с проявлением симптомокомплекса СПКЯ.
Нарушение жирового обмена
Имеется прямая зависимость между индексом массы тела (ИМТ) и уровнем тестостерона в крови. При этом висцеральное ожирение имеет большее значение, нежели периферическое, т.к. висцеральная жировая ткань богаче иннервирована, лучше кровоснабжается и отток крови происходит непосредственно в портальную систему печени. Последний факт обуславливает жировую дистрофию печени вследствие поступления большого количества свободных жирных кислот (СЖК). Адипоциты висцеральной жировой ткани содержат больше β3-адренорецепторов, кортикостероидных, андрогенных рецепторов, и, наоборот, относительно малое количество рецепторов к инсулину и α2-адренорецепторов [8,14]. Вследствие этого висцеральная жировая ткань имеет высокую чувствительность к липолитическому действию катехоламинов и низкую – к антилиполитическому действию инсулина.
Гиперинсулинемия и инсулинорезистентность
Одним из механизмов формирования системной гиперинсулинемии является поступление в печень большого количества СЖК, что, в свою очередь, опосредует синтез и высвобождение липопротеидов очень низкой плотности (ЛПОНП) и способствует повышению резистентности к инсулину скелетной мускулатуры, т.к. поглощение глюкозы ими снижается вследствие конкурентного метаболизма СЖК. Таким образом, избыток СЖК способствует развитию гипергликемии и гиперинсулинемии. На фоне дефицита эстрадиола и гиперинсулинемии в сыворотке крови снижается уровень глобулина, связывающего половые гормоны (ГСПГ), который связывает тестостерон. В результате этого возрастает концентрация свободного тестостерона в крови.
Сочетание гиперандрогении и инсулинорезистентности при СПКЯ было впервые выявлено Burghen G.A. с соавт. в 1980 г. Согласно последним представлениям, имеется несколько патогенетических механизмов формирования инсулинорезистентности у пациенток с СПКЯ. Среди них генетическая предрасположенность, нарушение секреции инсулина β-клетками поджелудочной железы, воздействие андрогенов на скелетные мышцы, нарушение метаболизма инсулина в печени, серинфосфорилирование инсулинового рецептора, нарушения на пути трансдукции инсулинового сигнала в клетку.
Дефекты ферментных систем
Имеются данные о повышении активности 17α-гидрогеназы, превращающей 17-гидроксипрегненолон в ДЭА и 17-оксипрогестерон в андростендион, у женщин с СПКЯ. Значимую роль в патогенезе может играть и недостаточность 17β-гидроксистероид-дигидрогеназы, которая блокирует превращение андростендиона в тестостерон и эстрона в эстрадиол, а также недостаточность 19-гидроксилазы на одном из заключительных этапов стероидогенеза. Следствием этого может быть увеличение концентрации андрогенов в крови при пониженном или нормальном уровне эстрогенов. У пациенток с нормальной массой тела гиперандрогения может детерминироваться дисрегуляцией цитохрома Р450с17 – ключевого фермента синтеза андрогенов как в яичниках, так и в надпочечниках.
Эндокринная патология
При ряде эндокринопатий, например, при первичном гипотиреозе, наблюдается снижение уровня тиреоидных гормонов, в частности тироксина (Т4), а также происходит повышение выработки в нейросекреторных клетках гипоталамуса тиреотропин-рилизинг-гормона (тиролиберина, ТРГ) - нейропептида, принимающего участие в регуляции психических функций, стимулирующего синтез ТТГ, пролактина (в меньшей степени) и α-субъединиц ЛГ и ФСГ, поскольку структура этой субъединицы одинакова для всех трех гормонов (ЛГ,ФСГ, ТТГ). В результате синхронно повышается синтез β-субъединиц и, соответственно, уровень секреции ЛГ гипофизом. Тиреоидные гормоны также регулируют водный обмен: снижают гидрофильность тканей и канальцевую реабсорбцию воды [26,27].
Наследственные факторы
Имеются данные о более высокой вероятности наличия СПКЯ у родных сестер, однояйцевых близнецов, матерей и дочерей женщин, имеющих данную патологию. Известно, что СПКЯ или факторы, к нему предрасполагающие, могут наследоваться как по женской, так и по мужской линии. Одним из примеров могут являться неклассические формы врожденной гиперплазии надпочечников (ВГПН) - недостаточности 3-β-гидроксистероиддегидрогеназы, 21-гидроксилазы и 11-β-гидроксилазы проявляются у детей старшего возраста, в пубертатном периоде и у взрослых. При этом считается, что неклассическая форма недостаточности 21-гидроксилазы является наиболее часто встречающейся аутосомно-рецессивной наследственной болезнью человека: среди людей белой расы ее частота составляет 0,01%, у евреев ашкенази – 3,7% (1:27) [12]. При этой форме ВГПН имеется недостаточность фермента, превращающего прогестерон в кортикостероиды, поэтому надпочечники секретируют избыточное количество андрогенов (андростендион), который превращается в эстрон. Последний, по механизму обратной связи, усиленно стимулирует секрецию ЛГ, являясь пусковым механизмом формирования СПКЯ.
Вышеперечисленные данные можно дополнить предложенные сотрудниками кафедры акушерства и гинекологии МГМСУ вариантами патогенеза СПКЯ у пациенток с нормальной массой тела (рис. 1) и у инсулинорезистентных пациенток (рис. 2). По мнению исследователей, на одни и те же генетические причины надпочечниковой и яичниковой гиперандрогении у пациенток с нормальной массой тела указывают как данные анамнеза, так и клинические данные, поскольку частота перенесенных заболеваний не была выше, чем в популяции и, кроме нарушения менструальной и репродуктивной функции, пациенток ничего не беспокоит. В это же время у пациенток с ожирением была увеличена частота ОРВИ и диэнцефальных симптомов, что может указывать на вовлечение в патогенез центральных, гипоталамических структур, в частности - нарушения нейроэндокринного контроля секреции ГнРГ [4,16].
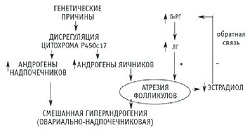 | Рисунок 1: Патогенез СПКЯ у женщин с нормальной массой тела. |
 | Рисунок 2: Патогенез СПКЯ у пациенток с инсулинорезистентностью. |
Патогенез СПКЯ у инсулинорезистентных больных, согласно этим представлениям, имеет некоторые отличия. Физиология пубертатного периода характеризуется инсулинорезистентностью, обусловленной повышенной продукцией соматотропного гормона (СТГ). Инсулин, как важный митогенный гормон, необходим в пубертате в повышенных концентрациях для нормального физического развития и созревания органов и тканей репродуктивной системы. Как уже отмечалось, это критический период в жизни, когда может быть манифестация любой генетически обусловленной патологии, особенно под воздействием различных средовых факторов.
Таким образом, СПКЯ является полиэтиологическим синдромом, патогенез которого реализуется различными механизмами у пациенток с нормальной массой тела и у женщин с ожирением и инсулинорезистентностью. Несмотря на это ключевыми факторами формирования СПКЯ во всех случаях являются первичные или вторичные нарушения регуляции в системе гипоталамус-гипофиз, приводящие к усиленной секреции ЛГ и, как следствие, к увеличению соотношения ЛГ/ФСГ. Увеличение секреции ЛГ способствует атрезии фолликулов, овариальной гиперандрогении. Андрогены приводят к гиперплазии белочной оболочки, стромы, тека-клеток, увеличению объема яичников, что клинически проявляется гирсутизмом и другими симптомами СПКЯ.
Клиническая картина
Симптомы, наблюдающиеся у пациенток с СПКЯ, весьма многообразны. Основные симптомы, клинические или биохимические признаки избыточной активности или секреции андрогенов, олиго- или ановуляция, поликистоз яичников при УЗИ, положены в основу диагностики СПКЯ согласно Роттердамскому консенсусу (2003 г.). Клиническими признаками, связанными с избытком андрогенов, являются гирсутизм, себорея, угревая сыпь, андроидное облысение.
Симптомы СПКЯ, как правило, начинают появляться с возраста менархе. При этом нарушения менструального цикла встречаются в 70% наблюдений, тогда как гирсутизм и ожирение не являются обязательными симптомами СПКЯ, встречаясь, по данным разных авторов, в 56-88% и 43-82% наблюдений соответственно [11,17].
Нарушение менструального цикла с периода менархе по типу олигоаменореи отмечается у подавляющего большинства женщин – в 70% наблюдений. Реже, у 7-9% пациенток, наблюдаются расстройства менструального цикла в виде дисфункциональных маточных кровотечений (ДМК). Вторичную аменорею имеют до 30% нелеченных пациенток с СПКЯ независимо от массы тела [4].
У большинства пациенток с СПКЯ (около 90%) отмечается первичное ановуляторное бесплодие. Соответственно, около 10% пациенток имеют в анамнезе беременности, наступившие без лечения бесплодия. Однако большинство беременностей заканчивается самопроизвольным прерыванием на ранних сроках [4].
Метаболические нарушения (висцеральное ожирение) могут сопутствовать СПКЯ, хотя частота их у таких пациенток в последнее время снизилась. В последние годы в структуре СПКЯ все чаще (около 50%) встречаются женщины с нормальной массой тела, слабовыраженными андрогензависимыми дерматопатиями (угревая сыпь на коже, в основном на лице и спине), со скудно выраженным гирсутизмом.
При этом время начала заболевания ретроспективно сложно установить, т.к. СПКЯ прогрессирует постепенно и начало декомпенсации репродуктивной системы с появлением клинических симптомов зависит от степени ее несостоятельности и способности противостоять факторам, способствующим развитию СПКЯ. К последним относятся инфекционные заболевания, чрезмерные физические и психические нагрузки и т.д. [10,17].
Диагностика
В качестве основных жалоб могут быть нарушение менструального цикла, бесплодие, самопроизвольные выкидыши на ранних сроках беременности, избыточное оволосение, угревую сыпь и ожирение.
Общий клинический осмотр
Общеклиническое обследование включает изучение анамнеза, осмотр с проведением антропометрических методов исследования. У большинства пациенток с СПКЯ наследственность отягощена нарушением менструальной и репродуктивной функции по женской линии. Ожирение, гипертоническая болезнь, инсулиннезависимый сахарный диабет могут встречаться и по мужской линии родства, чаще в семьях пациенток с ожирением.
Состояние молочных желез у большинства пациенток с СПКЯ характеризуется фиброзно-кистозной болезнью (ФКБ), развивающейся на фоне хронической ановуляции и гиперэстрогении. Примерно у 20-25% женщин может быть выделение молозива в результате функциональной гиперпролактинемии.
Для диагностики метаболического синдрома определяют индекс массы тела (ИМТ) и проводят выявление инсулинорезистентности (ИР). По данным сотрудников кафедры акушерства и гинекологии МГМСУ, частота инсулинорезистентности в зависимости от массы тела распределяется следующим образом: при ИМТ<25 – 25-30%; при ИМТ 26-30 – 40-45%; при ИМТ >30 – 80-85%, соответственно [4].
Гинекологическое исследование
При гинекологическом исследовании обращает на себя внимание оволосение наружных половых органов по мужскому типу (примерно у 65% женщин с СПКЯ), нигроидный акантоз (участки гиперпигментации кожи в местах трения, чаще встречается у пациенток с висцеральным типом ожирения). Увеличенные яичники определяются только у женщин с нормальной массой тела. Проявления гиперандрогении в виде гипертрофии клитора не характерны.
Биохимическое исследование крови
Лабораторная диагностика СПКЯ основана на исследованиях концентрации связанных с белками половых стероидов в сыворотке крови. Однако клиническую картину преимущественно определяют свободные биологически активные половые гормоны. Поэтому результаты биохимического исследования крови оправданно использовать в комплексной оценке вместе с учетом клинических проявлений гиперандрогении и ановуляции, а также данных УЗИ.
В качестве биохимических признаков расценивается увеличение концентрации свободного тестостерона в сыворотке крови свыше 8,9 пмоль/л, концентрации общего тестостерона более 2,5 нмоль/л. Также наличие СПКЯ могут характеризовать увеличение уровня ЛГ >10 мЕД/л; увеличение соотношения ЛГ/ ФСГ >2,5; уменьшение уровня глобулина, связывающего половые гормоны (ГСПГ); повышение концентраций пролактина – у 30-35% пациенток с СПКЯ; увеличение уровня 17-OHP (не выше скрининговых значений для НК-ВДКН – 2 нг/мл) и дегидроэпиандростерона (ДГЭАС) – у 50% пациенток с СПКЯ.
Степень информативности данных показателей для диагностики СПКЯ в настоящее время остается предметом для дискуссий. Так, ряд исследователей считает малоинформативным определение андростендиона и свободных фракций тестостерона. Увеличение соотношения ЛГ/ФСГ >3,0 в настоящее время не считается критерием диагностики, так как отмечается лишь у 40% пациенток. Более чувствительным методом диагностики гиперандрогении признано определение индекса свободных андрогенов (ИСА). Более информативным представляется и увеличение индекса ЛГ/ФСГ >2,5, что наблюдается примерно у 65% пациенток с СПКЯ. Повышенная концентрация ДГЭАС (основного андрогена надпочечников) наблюдается у большинства пациенток с висцеральным ожирением и положительно коррелирует с уровнем кортизола, что свидетельствует о центральном генезе активации ГГНС, повышения продукции АКТГ и, как следствие, ДГЭАС и кортизола. К сожалению, именно на основании повышенной концентрации ДГЭАС у пациенток с ожирением практикующие врачи назначают дексаметазон, т.е. препарат кортизола, что не является патогенетически обоснованным и приводит к прогрессированию висцерального ожирения. Примерно у 30% пациенток с нормальной массой тела увеличение концентраций ДГЭАС может указывать на генетически детерминированную дисрегуляцию цитохрома Р450с17 – ключевого энзима в биосинтезе овариальных и надпочечниковых андрогенов, т.е. имеет место общность механизмов гиперандрогении в яичниках и надпочечниках. Определение только концентраций 17-OHP малоинформативно, поскольку данный метаболит является предшественником андрогенов как в яичниках, так и в надпочечниках и закономерно повышен при СПКЯ.
У женщин с ожирением в возрасте старше 30 лет целесообразно определение липидов крови для выявления дислипидемии, являющейся результатом гиперинсулинемии. Дислипидемия характеризуется повышением факторов атерогенности: триглицеридов, холестерина, липопротеинов низкой и очень низкой плотности (ЛПНП, ЛПОНП), а также снижением уровня липопротеинов высокой плотности (ЛПВП) [4].
«Золотым стандартом» диагностики инсулинорезистентности является эугликемический клемп – метод, основанный на определении количества утилизированной периферическими тканями глюкозы, которая вводится внутривенно вместе с инсулином. Если имеется резистентность периферических тканей к инсулину, то количество вводимого инсулина, требующегося для поддержания нормогликемии, будет прогрессивно нарастать в зависимости от степени нарушения чувствительности к инсулину. Однако, в силу ряда технических и экономических ограничений, эугликемический клемп не получил широкого распространения в клинической практике. В этих условиях можно рекомендовать тестирование на инсулинорезистентность с помощью орального глюкозотолерантного теста (ОГТТ): концентрация глюкозы и инсулина определяется в сыворотке крови натощак, а затем – через 2 часа после приема 75 г глюкозы. Пик инсулинемии приходится на 60 мин проведения ОГТТ, на 120 мин у большинства здоровых женщин уровень инсулина приходит к исходным значениям, но может быть незначительно повышен. Если через 2 часа уровень глюкозы в крови приходит к исходным цифрам, а концентрация инсулина остается повышенным ≥1,5 раза, это свидетельствует о наличии инсулино-резистентности у пациентки. Если через 2 часа повышен уровень не только инсулина, но и глюкозы – это свидетельствует о нарушенной толерантности к глюкозе. При этом отмечается повышение базальных концентраций инсулина.
Ультразвуковое исследование
Критериями ПКЯ при УЗИ служат объем яичников (ДхШхП / Зх0,5) > 10 мл или см3, количество атретичных фолликулов диаметром 2-9 мм ≥ 10-12. При этом имеется корреляция между размером фолликулов и уровнем гормонов в сыворотке крови: чем меньше диаметр фолликулов и больше их количество, тем выше уровни ЛГ и тестостерона [4,17]. Также имеется положительная корреляция между объемом яичников, гиперэхогенностью стромы, степенью инсулинорезистентности, уровнями ЛГ и тестостерона. Именно увеличение объема яичников за счет гиперэхогенной стромы помогает дифференцировать поликистоз яичников (ПКЯ) от мультифолликулярных яичников (МФЯ). МФЯ чаще наблюдаются в раннем пубертатном периоде, при гипогонадотропной аменорее, синдроме резистентных яичников. Картина МФЯ при УЗ-исследовании характеризуется небольшим количеством фолликулов диаметром 4-10 мм, которые расположены по всему яичники, и небольшим количеством стромы со слабым эхосигналом между фолликулами [4,5].
Лапароскопическое исследование
Лапароскопия долгие годы считалась самым информативным методом диагностики СПКЯ. С совершенствованием методов УЗИ лапароскопии в настоящее время отводится основная роль в хирургическом лечении и выявлении сопутствующих факторов бесплодия [4,5,16].
Биопсия эндометрия
Биопсия эндометрия показана женщинам с ациклическими кровотечениями в связи с большой частотой гиперпластических процессов эндометрия. Показанием к выскабливанию также являются эхографические признаки гиперплазии эндометрия при отсутствии клинических проявлений. В настоящее время не вызывает сомнений, что у женщин с СПКЯ высокий риск развития рака эндометрия. Отягощающими факторами являются метаболические нарушения и длительность ановуляции [4,5].
Функциональная диагностика
Обследование по тестам функциональной диагностики (измерение базальной температуры, УЗИ мониторинг фолликулогенеза), особенно у пациенток с олигоаменореей, целесообразно использовать не для диагностики, а как критерий эффективности проводимого лечения, направленного на восстановление овуляторных менструальных циклов [45].
Лечение
Лечение женщин с СПКЯ является комплексным. Основными задачами лечения являются нормализация массы тела, контроль метаболических нарушений, восстановление менструального цикла и репродуктивной функции, лечение и профилактика гиперпластических процессов эндометрия, а также устранение клинических проявлений гиперандрогении, в т.ч. андрогензависимых дерматопатий.
Комплексная метаболическая терапия включает рациональное питание (соблюдение соответствующей диеты) и медикаментозные средства контроля массы тела. Как правило, при необходимости в медикаментозных средствах назначают селективные ингибиторы обратного захвата серотонина и норадреналина (сибутрамин), стимулятор центральных и периферических D2-дофаминовых рецепторов (бромокриптин), средства, препятствующие всасыванию жиров (ингибитор желудочно-кишечных липаз − орлистат). Женщинам с установленной инсулинорезистентностью показан метформин. Он подавляет глюконеогенез, а также образование свободных жирных кислот и окисление жиров. Метформин не влияет на количество инсулина в крови, но изменяет его фармакодинамику за счет снижения соотношения связанного инсулина к свободному и повышения соотношения инсулина к проинсулину. Метформин назначается по 1000-1500 мг/сутки под контролем индекса НОМА или ОГТТ на срок 3-6 месяцев, в т.ч. на фоне стимуляции овуляции [4,5,17].
С целью стимуляции овуляции может применяться кломифена цитрат. Кломифена цитрат относится к классу селективных модуляторов эстрогеновых рецепторов. Механизм действия кломифена основан на блокаде рецепторов эстрадиола на всех уровня репродуктивной системы. После его отмены по механизму обратной связи происходит усиление секреции гонадолиберина, что нормализует выброс ЛГ и ФСГ и, соответственно, овариальный фолликулогенез. Таким образом, кломифена цитрат не оказывает прямое стимулирующее воздействие непосредственно на яичники, а воздействует через гипоталамо-гипофизарную систему. Кломифена цитрат назначается с 5 по 9 день менструального цикла по 50 мг в день. При отсутствии овуляции по данным базальной температуры и результатам УЗИ дозу кломифена можно увеличивать в каждом последующем цикле на 50 мг, достигая 100, максимально - 150 мг в день. Однако многие исследователи полагают, что если нет эффекта при назначении 100 мг, то дальнейшее увеличение дозы КЦ нецелесообразно. При отсутствии овуляции при максимальной дозе в течение 3 месяцев пациентку можно считать резистентной к кломифену. При наличии овуляции дозу кломифена повышать не следует, так как это может лишь усилить антиэстрогенный эффект препарата. В последние годы используются комбинированные схемы контролируемой индукции овуляции, где кломифена цитрат комбинируют с человеческим хорионическим гонадотропином (чХГ), препаратами натурального прогестерона и т.д. Эффективность комбинированной терапии может быть выше, чем монотерапии кломифеном, однако возрастает и риск нежелательных явлений, таких как синдром гиперстимуляции яичников (СГЯ) [4,5].
Все более широкое распространение получает метод индукции овуляции с рекомбинантными агонистами гонадотропного рилизинг-гормона (а-ГнРГ), подавляющего пики избыточной секреции ЛГ, что улучшает качество ооцитов и снижает риск развития СГЯ. Также применяются протоколы с антагонистами гонадотропного рилизинг-гормона (ант-ГнРГ), которые вызывают немедленную супрессию гипоталамогипофизарной системы без стадии активации. Преимуществами ант-ГнРГ по сравнению с а-ГнРГ могут быть снижение длительности общего лечения на 12-14 дней; уменьшение длительности непосредственной стимуляции ГТ; меньший расход стимуляторов овуляции, в связи с этим снижение стоимости лечения; отсутствие нежелательных побочных эффектов, хотя для их подтверждения требуются широко-масштабные клинические исследования [5,17].
Также ряд исследователей предлагает новые терапевтические подходы к лечению СПКЯ с использованием статинов (ингибиторов редуктазы) в качестве корректоров дислипидемии. Статины традиционно используют для снижения уровня холестерина в крови, однако они обладают еще и плейотропным действием, оказывая антиокислительный, противо-воспалительный и антипролиферативный эффект.
К настоящему времени накоплены результаты исследований “in vitro” и “in vivo”, которые дают возможность рекомендовать статины в лечении СПКЯ. Однако, прежде чем вводить статины в стандарты терапии СПКЯ, необходимы дополнительные расширенные клинические исследования [9].
Необходимо отметить, что традиционно применяющийся метод стимуляции овуляции назначением эстроген-гестагенных препаратов, основанный на ребаунд-эффекте после их отмены, практически не теряет своей популярности, но на практике малоэффективен [4,5].
Применение эстроген-гестагенных препаратов в виде комбинированных оральных контрацептивов (КОК) более целесообразно при необходимости торможения секреции гонадотропинов, когда есть опасения развития выраженных гипоэстрогенных проявлений на фоне терапии а-ГнРГ (остеопороз, вагинальная атрофия, гипоплазия молочных желез и матки, атрофия эндометрия, вегетативные реакции, обусловленные недостатком эстрогенов и т.д.). В этой ситуации у женщин репродуктивного возраста показано комбинированное применение а-ГнРГ и КОК [17].
Также оправданно применять КОК после родов с целью предупредить рецидив СПКЯ. Известно, что при высокой эффективности различных методов стимуляции овуляции (восстановление репродуктивной функции у пациенток c СПКЯ после индукции овуляции в среднем происходит в 80-85% случаев), остается высоким риск возобновления клинических симптомов после родов. Поэтому после реализации репродуктивной функции необходима профилактика рецидива СПКЯ, что особенно важно с учетом высокой вероятности развития гиперпластических процессов эндометрия и отдаленных последствий инсулинорезистентности – сердечно-сосудистых заболеваний, инсулин-независимого сахарного диабета [4,5,17].
Эстрогенный компонент КОК (этинилэстрадиол, входящий в состав большинства современных КОК), повышает уровень в крови ГСПГ, снижая, таким образом, концентрации свободного биологически активного тестостерона. Кроме того, КОК подавляют секрецию ЛГ и ФСГ в гипофизе, что приводит к снижению продукции андрогенов в яичниках, уменьшению объема ПКЯ. Прогестагенный компонент КОК конкурентно связывается с рецепторами андрогенов и может оказывать антиандрогенное действие на ткани-мишени, благоприятное действие на эндометрий, предотвращая развитие гиперпластических процессов [4,23,26].
Благодаря наличию антиандрогенного действия КОК сегодня являются наиболее популярной терапией андрогензависимых дерматопатий у пациенток с СПКЯ. При этом рекомендуют КОК, содержащие прогестагены третьего поколения, которые, в отличие от прогестагенов 2 поколения, не блокируют эстроген стимулированное повышение концентрации ГСПГ. В последние годы большинство исследователей пришли к заключению о целесообразности пролонгированного (ежедневного) применения КОК у пациенток с СПКЯ, поскольку в 7-дневный перерыв усиливается секреция ЛГ и, соответственно, выработка андрогенов в яичниках. Это, в свою очередь, снижает эффективность их антиандрогенного действия. Т.к. цикл роста волос составляет 6-24 месяца, то и терапия гирсутизма КОК должна быть длительной. Как правило, большинство пациенток отмечает положительную динамику в терапии гирсутизма через 9 месяцев использования КОК [4,5]. Также в процессе консультирования, который должен сопровождать любое назначение гормональных контрацептивов, важно правильно ориентировать женщину на продолжительное использование КОК [1], т.к. после отмены препарата у большинства женщин симптомы гиперандрогении (гирсутизм, акне) с большой степенью вероятности возобновятся.
При выраженных проявлениях гирсутизма КОК рекомендуется сочетать с антиандрогенами, которые оказывают периферическое действие: блокаторы андрогенных рецепторов (спиронолактон, флутамид) и ингибиторы фермента 5 α-редуктазы – финастерид. Надежная контрацепция в период терапии данными препаратами тем более необходима, т.к. они способны проникать через плацентарный барьер и способствовать феминизации плодов мужского пола [4,5,23,26].
Т.к. при СПКЯ показано длительное применение гормональных препаратов, в ряде случаев – КОК в пролонгированном режиме, современные монофазные КОК, содержащие прогестагены последнего поколения, более предпочтительны. Таким комбинированным оральным контрацептивом является Мидиана производства компании Гедеон Рихтер (Венгрия), появившаяся в России в 2011 году. Мидиана содержит 30 мкг этинилэстрадиола и 3 мг дроспиренона. Дроспиренон, являющийся прогестагеном последнего поколения, представляет собой аналог блокатора периферических рецепторов к андрогенам – спиронолактона. Дроспиренон обладает антиминералокортикоидным эффектом, благодаря чему предотвращает симптомы эстрогенов, связанные с задержкой натрия, что клинически проявляется прибавкой веса, отеками и масталгией. Также благодаря антиандрогенному действию дроспиренон эффективен в лечении дерматологических проявлений гиперандрогении, в т.ч. акне [22]. Известно, что все эстроген-содержащие КОК обладают антиандрогенным действием, которое основано на увеличение концентрации в крови глобулина, связывающего половые гормоны (ГСПГ). Вследствие этого снижается свободная (биологически активная) фракция андрогенов. Однако большинство прогестагенов предыдущего поколения нивелировали эти эффекты. Дроспиренон не оказывает влияния на вызванное эстрогенами повышение в крови содержания ГСПГ [3,5,15,18]. Такое антиандрогенное действие дроспиренона и позволяет использовать его дополнительные неконтрацептивные преимущества в терапии пациенток с СПКЯ.
Важно, что несмотря на то, что Мидиана сравнительно недавно появилась в арсенале гинекологов России, уже были проведены отечественные клинические исследования, подтвердившие эффективность и безопасность данного препарата [3,15,18]. Одним из таких собственных исследований стало изучение клинической эффективности и безопасности на базе кафедры акушерства и гинекологии МГМСУ, выполненное с участием 54 женщин 16-40 лет. После применения препарата в течение 6 циклов контрацептивная надежность составила 100%; ациклические кровянистые выделения отмечены в 4% циклов (при этом частота циклов с прорывными кровотечениями составила 0,3%); прибавка веса на 1-2 кг отмечалась у 9,3% женщин (при этом у 28% было отмечено снижение массы тела, связанное с антиминералокортикоидным эффектом дроспиренона); также у небольшого количества женщин отмечались масталгия, головные боли, изменения настроения и тошнота в первые циклы, которые исчезли позднее и не стали причиной прекращения приема препарата. Небольшая частота побочных эффектов позволила исследователям заявить о хорошей переносимости и высокой контрацептивной эффективности данного КОК [3]. Помимо высокой контрацептивной эффективности были подтверждены возможности применения Мидианы в лечении предменструального синдрома [15] и в комплексе реабилитационных мероприятий у больных хроническим сальпингоофоритом [18], где используются неконтрацептивные преимущества дроспиренона. Все это делает возможным рекомендовать Мидиану в качестве высокоэффективного и безопасного монофазного КОК с прогестагеном последнего поколения для применения в длительной терапии пациенток с СПКЯ, не заинтересованных в беременности.
Из хирургических методов лечения до 60-х годов прошлого века была распространена клиновидная резекция яичников. Теперь чаще используют каутеризацию яичников монополярным коагулятором или аргоновым лазером. В результате указанных вмешательств в крови стремительно падают концентрации тестостерона и андростендиона. В среднем у 70% пациенток восстанавливается овуляторная функция, снижается частота раннего прерывания беременности. Однако, даже при активном внедрении лапароскопических методик, после проведения данных хирургических вмешательств в малом тазе развивается различной степени выраженности спаечный процесс. Таким образом, если у пациентки, перенесшей хирургическое лечение, в кратчайший срок после проведенной процедуры не наступает беременность, то существенно возрастает риск развития непроходимости маточных труб, вновь возвращающей женщину к диагнозу «бесплодие», но уже другого генеза [16]. Поэтому, а также в связи с повышением эффективности медикаментозных методов терапии пациенток с СПКЯ, широта применения хирургических методов лечения в настоящее время уменьшается [7,16,23].
Заключение
Таким образом, СПКЯ является хроническим эндокринным заболеванием с не до конца изученным патогенезом. С внедрением Роттердамского консенсуса пересмотрены критерии диагностики СПКЯ, при этом частота встречаемости СПКЯ в последние годы увеличилась. Также растет доля женщин без увеличения массы тела, имеющих симптомы СПКЯ. При выборе терапии СПКЯ наряду с восстановлением репродуктивной функции необходимо проводить мероприятия, направленные на коррекцию и предупреждение развития метаболического синдрома, гиперпластических процессов в эндометрии, а также андрогензависимых дерматопатий. КОК в качестве единственного гормон-содержащего препарата, либо в составе комбинированной терапии с другими лекарственными средствами позволяет эффективно контролировать симптомы СПКЯ. Мидиана – монофазный КОК, содержащий прогестаген последнего поколения дроспиренон, который оправданно применять для эффективного и безопасного лечения клинических проявлений СПКЯ вследствие наличия антиминералокортикоидного и антиандрогенного эффектов. Применение дроспиренона в составе КОК у пациенток с СПКЯ наряду с контрацептивным эффектом способствует нормализации уровней ЛГ, тестостерона, уменьшению объема ПКЯ и положительно влияет на такие проявления СПКЯ, как увеличение массы тела, гирсутизм и акне. Это дает основания считать Мидиану патогенетически оправданным методом лечения пациенток с СПКЯ.
Литература:
1. Алесина И.Л. Консультирование женщин как важный инструмент при индивидуальном подборе метода контрацепции. Акушерство и гинекология. 2011; 6: 120-124
2. Блинов Д.В. Общность ряда нейробиологических процессов при расстройствах деятельности ЦНС. Эпилепсия и Пароксизмальные Состояния. 2011; 2: 28-33
3. Геворкян М.А., Манухин И.Б., Кузнецова Е.М. Опыт применения дроспиренон содержащего гормонального контрацептива. РМЖ. 2011; 19(2).
4. Геворкян М.А. , Манухин И.Б., Студеная Л.Б., Смирнова Л.И., Манухина Е.И. Клиника, диагностика и лечение синдрома поликистозных яичников. ЖРОАГ. 2008; 4: 35-48.
5. Геворкян М.А. , Манухин И.Б., Студеная Л.Б., Смирнова Л.И., Манухина Е.И. Синдром поликистозных яичников (патогенез, клиника, диагностика и лечение). Москва. Оржин. 2008; 32 с.
6. Григорян О.Р., Макарова И.И., Гродницкая Е.Э., Андреева Е.Н. Особенности синдрома поликистозных яичников у женщин с сахарным диабетом 1-го типа (обзор литературы). Проблемы репродукции. 2009; 1: 57-62
7. Гуриев Т.Д. Синдром поликистозных яичников. Акушерство, гинекология и репродукция. 2010; N2: c.10-15
8. Демидова Т.Ю. Ожирение и инсулинорезистентность. Трудный Пациент. 2006; 7: 25-28.
9. Ингибиторы редуктазы в терапии синдрома поликистозных яичников. Акушерство, гинекология и репродукция. 2008; 6: 3.
10. Ковальский Г.Б., Китаев Э.М., Рыжавский Б.Я. и др. Структурные основы генеративной и эндокринной функции яичников в норме и патологии. Санкт-Петербург. 1996; 176-182.
11. Крейгхилл М. Детская гинекология//Педиатрия, ред. Греф Д., М.,1997.- С.457-481.
12. Лавин Н. Эндокринология. Пер. с англ. В.И. Кандрор. Москва. Практика. 1999.
13. Манушарова М.А., Черкесова Э.И. Синдром поликистозных яичников: клиника, диагностика, лечение. Лечащий Врач. 2005; 10.
14. Ошорова С.Д., Андрущишина Т.Б., Морозова Т.Е. Индивидуализированный выбор антигипертензивных лекарственных средств при метаболическом синдроме: влияние на адипокины, маркеры эндотелиальной дисфункции. 2011; 2
15. Поздняк А.О. Медикаментозная терапия предменструального синдрома. Акушерство и Гинекология. 2011; 8: 117-120.
16. Тихомиров А.Л., Лубнин Д.М. Синдром поликистозных яичников: факты, теории, гипотезы. Международный эндокринологический журнал. 2007; 5(11).
17. Уварова Е.В. Возможности применения комбинированных оральных контрацептивов в пролонгированном режиме при лечении СПКЯ. Проблемы репродукции. 2006; 4:73-78
18. Шатунова Е.П., Степанова Ю.В. Применение гормональных контрацептивов в программе реабилитации после перенесенного обострения хронического сальпингоофорита. Акушерство и Гинекология. 2011; 2: 106-110.
19. Azziz R. Diagnosis of polycystic ovarian syndrome: the Rotterdam criteria are premature. Journal of Clinical Endocrinology & Metabolism. 2006; 91(3): 781–785.
20. Barnes R.B., Rosenfield R.L., Ehrman D.A. J. Clin. Endocrinol. Metab. 1994; 79: 1328-1332.
21. Carmina E (February 2004). «Diagnosis of polycystic ovary syndrome: from NIH criteria to ESHRE-ASRM guidelines.». Minerva ginecologica 56 (1): 1–6.
22. Colonna L., Pacifico V., Lello S., Sorge R., Raskovic D., Primavera G. Skin improvement with two different oestroprogestins in patients affected by acne and polycystic ovary syndrome: clinical and instrumental evaluation. J Eur Acad Dermatol Venereol. 2011 Oct 19. doi: 10.1111/j.1468-3083.2011.04292.x. [Epub ahead of print]
23. Eden J. Polycystic ovary syndrome. A womans guide to identifuing & managing PCOS. Allen & Unwin. 2005.
24. Hart R., Hickey M., Franks S. Definitions, prevalence and symptoms of polycystic ovaries and polycystic ovary syndrome. Best Practice & Research Clinical Obstetrics & Gynaecology. 2004; 18(5): 671–683.
25. Hirshfeld-Cytron J., Barnes R.B., Ehrmann D.A., Caruso A., Mortensen M.M., Rosenfield R.L. Characterization of functionally typical and atypical types of polycystic ovary syndrome. J Clin Endocrinol Metab. 2009; 94(5): 1587-1594.
26. Ehrmann D.A. Polycystic ovary syndrome. N Engl J Med 2005;352:1223-36.
27. Nillni E.A., Sevarino K.A.. The biology of prothyrotropinreleasing hormone-derived peptides. Endocrine Reviews. 1999; 20(5): 599-648.
28. O’Leary R., O’Connor B. Thyrotropin-releasing hormone. Short review. J. Neurochem. 1995; 65: 953-963.
29. Polycystic Ovary Syndrome (PCOS). US Department of Health and Human Services. 2008; 29 p.
30. Stein I.L., Leventhal M.L. Amenorrhea associated with bilateral polycystic ovaries. Am J Obstet Gynecol. 1935; 29: 181-191.
COMBINED ORAL CONTRACEPTIVES IN TREATMENT OF PATIENTS WITH POLYCYSTIC OVARY SYNDROME
Gevorkyan M.A.1, Blinov D.V.2, Smirnova S.O.1
1 State Budget Educational Institution of Higher Professional Training «Moscow State Medical Stomatological University» Ministry of Healthсare and Social Development of the Russian Federation
2 State Budget Educational Institution of Higher Professional Training «Russian national Research Medical University named after N.I. Pirogov» Ministry of Healthсare and Social Development of the Russian Federation
Abstract: Polycystic Ovary Syndrome (PCOS) presents actual problem in gynecology. In present time discussions on PCOS classification and diagnostics criteria are not completed. Criteria accepted by Rotterdam consensus experts in 2003 year are mostly used. According these criteria PCOS diagnosis is made in case when 2 of 3 following signs take place: symptoms of high activity or increased produce of androgens (clinical or biochemical); oligoovulation or anovulation; polycystic ovaries at ultrasound examination. Combined oral contraceptives (COC) play important role in treatment of PCOS. It’s reasonable to use monophasic COC, containing the last generation progestogens, like drospirenone. Use of COCs with antiandrogenic activity is pathogenically reasonable and facilitates normalization of luteinizing hormone (LH) level, decreases androgens production in ovaries as well as their size and also has beneficial effect on PCOS symptoms like overweight, hirsutism and acne.
Key words: PCOS, hirsutism, acne, COC, GnRH, FSH, estradiol, drospirenone |
|